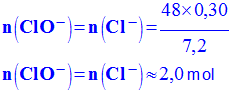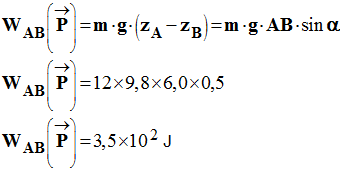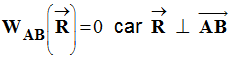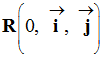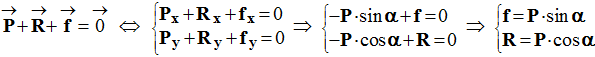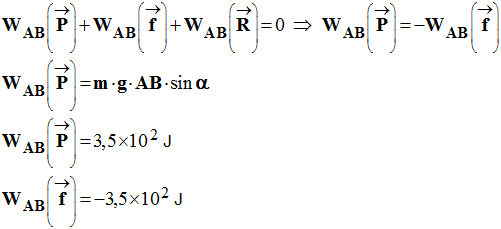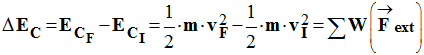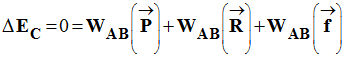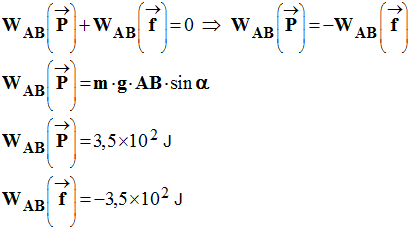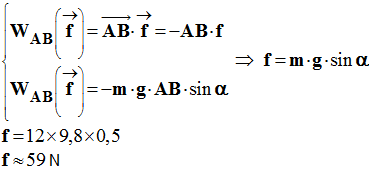|
Correction |
|
|
|
|
1)- Définir un acide et une base selon Brönsted. - Acide : entité chimique capable de céder un ou plusieurs protons. - Base : espèce chimique capable de capter un ou plusieurs protons.
2)- Donner la définition d’une réaction acido-basique. - Une réaction acido-basique est un transfert de protons en un acide d’un couple acide / base et une base d’un autre couple acide / base
3)- Les entités H3O
+ et
HO
– constituent-elles un couple acide / base ? Justifier votre
réponse. - Les entités H3O + et HO – ne constituent pas un couple acide / base conjuguée. - L’ion H3O + est l’acide du couple H3O + / H2O et HO – est la base du couple H2O / HO –.
4)- Identifier les formes acides et bases conjuguées parmi les entités chimiques ci-dessous. Préciser, pour chacun des couples, la forme acide et la forme basique. |
|
HClO
(aq) |
HClO2 (aq) |
H2PO3
–
(aq) |
H3PO4
(aq) |
ClO
–
(aq) |
H2PO4
–
(aq) |
ClO2
–
(aq) |
H3PO3
(aq) |
HPO42–
(aq) |
|
- Quelle particularité possède l’ion H2PO4 – (aq) ? Comment nomme-t-on les entités chimiques qui possèdent cette particularité ? - Particularité de l’ion dihydrogénophosphate H2PO4 – (aq) : |
||||
|
HClO
(aq)
/ClO
–(aq) |
HClO2
(aq)
/ClO2–(aq)
|
H3PO3(aq)
/H2PO3–(aq) |
H3PO4(aq)
/H2PO4–(aq) |
H2PO4
–(aq)
/HPO42
(aq) |
|
- L’ion
H2PO4
–(aq) est
l’acide d’un couple et la base d’un autre couple.
-
C’est une espèce amphotère ; c’est un ampholyte.
|
||||
|
1)- Qu’appelle-t-on réaction d’oxydoréduction ?
Comment appelle-t-on un
réactif qui fournit des électrons ?
Un réactif qui capte des électrons ? - Une réaction d’oxydoréduction résulte d’un transfert d’électrons entre l’oxydant d’un couple Ox / Red et le réducteur d’un autre couple Ox / Red. - Un réactif qui fournit des électrons est un réducteur : Red = Ox + n e – - Un réactif qui capte des électrons est un oxydant car : Ox + n e – = Red.
2)- Constitution de l’eau de Javel.
L’eau de Javel est préparée en faisant agir du dichlore avec une
solution aqueuse d’hydroxyde de sodium. a)- Deux couples oxydant réducteur du dichlore sont mis en jeu simultanément :
ClO –
(aq) /
Cl2
(g) et
Cl2 (g)
/ Cl –
(aq) - Écrire les demi-équations électroniques correspondantes. - Demi-équations : - Couple : ClO – (aq) / Cl2 (g) : 2 ClO – (aq) + 2 e – + 4 H + (aq) = Cl2 (g) + 2 H2O - Couple : Cl2 (g) / Cl – (aq) : Cl2 (g) + 2 e – = 2 Cl – (aq)
b)- À partir de ces deux demi-équations, proposer une équation chimique ayant pour seuls réactifs Cl 2 (g) et H 2O.
Quelle originalité présente cette
équation chimique ? - Originalité de cette équation chimique :
- Le dichlore joue le rôle d’oxydant et de réducteur dans cette réaction (dismutation).
c)- En combinant l’équation chimique précédente avec l’équation chimique représentant la réaction entre
les ions
H + (aq)
et HO –
(aq), écrire l’équation de la
réaction du dichlore avec les ions
HO –
(aq). - Équation de la réaction du dichlore avec les ions HO – (aq).
d)-
Quels ions sont essentiellement présents dans l’eau de Javel ? - Les ions présents dans l’eau de Javel : - Les ions chlorure Cl – (aq) , les ions hypochlorite ClO – (aq) et les ions sodium Na + (aq)
e)-
L’ion chlorure est-il oxydant ? Justifier la réponse. En déduire l’ion
oxydant contenu dans l’eau de Javel. - L’ion chlorure n’est pas un oxydant, c’est le réducteur du couple Cl2 (g) / Cl – (aq). - L’ion oxydant contenu dans l’eau de Javel est l’ion : ClO – (aq) (et Na + (aq))
3)- Degré chlorométrique.
On a vu dans la question précédente que le dichlore donne, en milieu
basique, des ions chlorure Cl
– (aq)
et des ions hypochlorite
ClO – (aq).
En milieu acide, c’est la
réaction inverse qui a lieu :
ClO
–
(aq)
+
Cl – (aq)
+ 2
H+ (aq)
→
Cl2
(g) +
H2O
On appelle degré chlorométrique d’une eau de Javel, le volume de
dichlore gazeux que peut libérer,
par cette réaction, un litre d’eau de
Javel.
a)-
Calculer la quantité de matière
n (Cl2) de
dichlore que peut libérer
et autant d’ions
chlorure Cl –
(aq),
en présence
d’un excès d’ions H+ (aq).
- Quantité de matière
n (Cl2) de dichlore que peut libérer
|
Tableau d’avancement de la réaction :
|
Équation : |
ClO
– (aq) |
+
Cl – (aq) |
+ 2
H+ (aq) |
→ |
Cl2
(g) |
+
H2O |
|
E.I |
n1 = 0,30
mol |
n1 = 0,30
mol |
excès |
0 |
solvant |
|
|
E.F |
n1 –
xmax = 0 |
n1 –
xmax = 0 |
excès |
xmax |
solvant |
|
- En conséquence : n (Cl2) = xmax = n1 = 0,30 mol b)- Calculer la valeur du degré chlorométrique de cette eau de Javel.
- On
prend m =
- Volume de dichlore dégagé par
- V (Cl2) = n (Cl2) . V m - V (Cl2) = n1 . Vm = 0,30 x 24
- V
(Cl2) ≈ - Cette solution titre 7,2 ° chlorométrique. c)- L’eau de Javel commerciale titre 48 ° chlorométriques.
Calculer la
concentration molaire en ions hypochlorite et en ion chlorure de cette
solution.
- Quantité de matière en ion hypochlorite
de
-
- Concentration de la solution en ion hypochlorite : - [ClO – ] = [ClO – ] ≈ 2,0 mol / L |
III- Les aventures d’une valise.
|
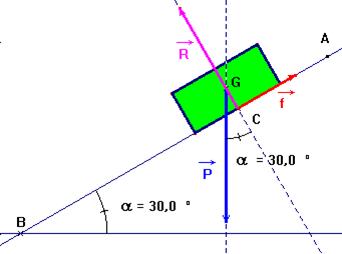
Au service de tri des bagages d’un aéroport, une valise de masse
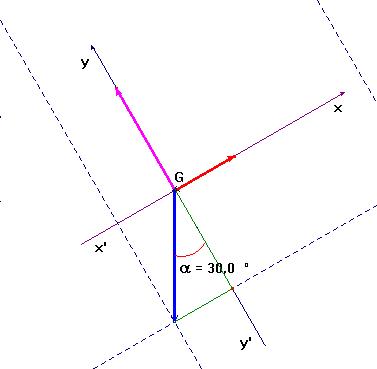
m = d’un angle α = 30 ° par rapport à l’horizontale. La valise glisse vers le bas à vitesse constante.
On donne : g = 9,8 N /
kg |
|
1)- Faire le bilan des forces extérieures exercées sur la valise. - On peut considérer que la valise est soumise à trois forces :
- le poids
-
la réaction perpendiculaire au support
- la force de
frottement
- Caractéristiques des différentes forces :
2)- Faire un schéma de la situation à l’instant
t. - Schéma à l’instant t :
3)- Calculer les travaux effectués par les différentes forces au cours
du
déplacement AB de longueur
d =
- Travaux effectués par les différentes
forces au cours du déplacement AB :
- - Travail de la réaction du support sur le chemin AB :
-
- Pour le travail de la force
- D’après la réciproque du principe de l’inertie, la valise est soumise à des forces dont les effets se compensent :
-
- On peut travailler dans le repère
-
-
4)- Indiquer si le travail de chacune des forces est moteur ou résistant.
- Le travail
du poids
5)- Énoncer le théorème de l’énergie cinétique. - Énoncé : - Dans un référentiel galiléen, la variation de l’énergie cinétique d’un solide en mouvement de translation entre deux instants tI et tF est égale à la somme des travaux des forces extérieures qui lui sont appliquées entre ces deux instants.
- On écrit :
6)- En appliquant le théorème de l’énergie cinétique à la situation décrite,
calculer la valeur
de la force de frottement
f supposée constante
exercée sur la valise. - Grâce au théorème de l’énergie cinétique, on peut facilement résoudre la question précédente : - Comme le mouvement est rectiligne uniforme, la vitesse du système ne varie pas entre les deux instants considérés. - La variation de l’énergie cinétique est nulle : - On écrit :
- - On en déduit que :
- - On retrouve la valeur de f :
- |