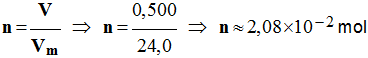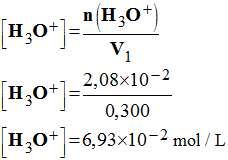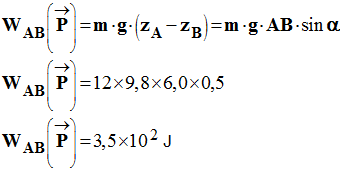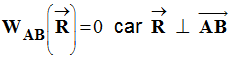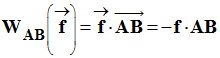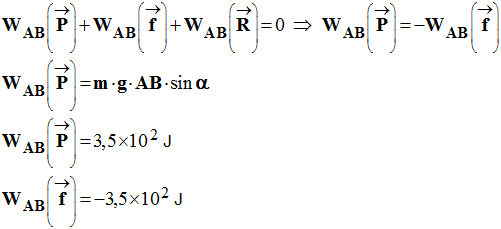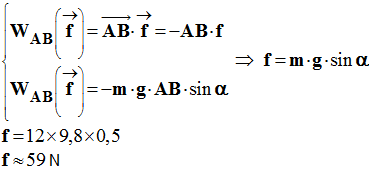|
Correction |
|
|
|
|
1)- Définir un acide et une base selon Brönsted. - Définitions : - Acide : entité chimique capable de céder un ou plusieurs protons. - Base : espèce chimique capable de capter un ou plusieurs protons.
2)- Donner la définition d’une réaction acido-basique. - Définition d’une réaction acido-basique : - Une réaction acido-basique est un transfert de protons entre : - un acide d’un couple acide / base - et une base d’un autre couple acide / base
3)- Les entités H3O+ et HO– constituent-elles un couple acide / base ? Justifier votre réponse. - Les entités H3O+ et HO– ne constituent pas un couple acide / base conjuguée. - L’ion H3O+ est l’acide du couple H3O+ / H2O et HO – est la base du couple H2O / HO–.
4)- Identifier les formes acides et bases conjuguées parmi les entités chimiques ci-dessous. Préciser, pour chacun des couples, la forme acide et la forme basique : |
|
HClO
(aq) |
HClO2 (aq) |
H2PO3–
(aq) |
H3PO4
(aq) |
ClO–
(aq) |
H2PO4–
(aq) |
ClO2–
(aq) |
H3PO3
(aq) |
HPO42–
(aq) |
|
5)-
Quelle particularité possède l’ion
H2PO4
– (aq) ?
Comment nomme-t-on les entités chimiques qui possèdent cette
particularité ? - Particularité
de l’ion
H2PO4
– (aq) |
||||
|
HClO
(aq)
/ClO–(aq) |
HClO2
(aq)
/ClO2–(aq)
|
|
H3PO4(aq)
/H2PO4–(aq) |
H2PO4–(aq)
/HPO42–
(aq) |
|
- L’ion
H2PO4–(aq) est
l’acide d’un couple et la base d’un
autre couple.
- C’est une espèce
amphotère ; c’est un ampholyte. |
||||
II- L’expérience du jet d’eau.
|
On dispose d’un ballon de volume V = 500 mL rempli de chlorure d’hydrogène gazeux.
On introduit de l’eau dans le ballon et on obtient finalement une
solution d’acide chlorhydrique de volume
V1 = 300 mL.
1)- Donner la formule du chlorure d’hydrogène. De quel couple acide / base fait-il partie ?
- Formule du chlorure d’hydrogène :
HCl
(g) - C’est l’acide du couple acide / base : HCl (ag) / Cl– (aq)
2)- Quel est le rôle de l’eau ? Quel est le couple de l’eau impliqué dans cette réaction ? - L’eau joue le rôle d’une base, elle capte un proton à la molécule de chlorure d’hydrogène. - Couple impliqué : H3O+ (aq) / H2O (ℓ) 3)- Écrire les demi-équations correspondant à ces deux couples acide / base. En déduire l’équation de la réaction.
4)- Calculer la quantité de matière n de chlorure d’hydrogène gazeux présent dans le ballon au début de l’expérience. - Quantité de matière n de chlorure d’hydrogène gazeux :
-
5)- Le réactif limitant est le chlorure d’hydrogène gazeux. - À l’aide d’un tableau d’avancement :
- Faire un bilan de matière à l’état initial,
- Déterminer la valeur de l’avancement maximal
xmax de la réaction, et
- Effectuer le bilan de matière à l’état final. |
Tableau d’avancement et bilan de matière :
|
Équation |
HCl
(g) |
+ H2O
(ℓ) |
→ |
H3O+ (aq) |
+
Cl–
(aq) |
|
|
État du
système |
Avancement |
|||||
|
État initial (mol) |
x = 0 |
n ≈
2,08
x 10 – 2 |
Excès
n’
≈ 16,7 |
0 |
0 |
|
|
Au cours de la transformation |
x |
n –
x |
Excès |
x |
x |
|
|
État final (mol) |
x = xmax |
n –
xmax
= 0 |
Excès |
xmax |
xmax |
|
|
|
xmax
≈
2,08
x 10–
2 |
0 |
Excès |
2,08
x 10–
2 |
2,08
x 10–
2 |
|
|
- Valeur de l’avancement maximal : - il est dit dans l’énoncé que le chlorure d’hydrogène est le réactif limitant. - En fin de réaction, il a totalement disparu. - On peut écrire : - n – xmax = 0
- n
= xmax
≈
2,08
x 10– 2 mol 6)- Calculer les concentrations molaires en ions oxonium [H3O+] et en ions chlorure [Cl– ] dans l’acide chlorhydrique. - Concentrations molaires. - D’après le tableau d’avancement, on déduit que : [H3O+] = [Cl–]
-
- [H3O+] =
[Cl–] ≈
6,93
x
10– 2 mol / L - Donnée : Dans les conditions de l’expérience, le volume molaire des gaz est :
-
Vm = 24,0 L / mol. |
III- Les aventures d’une valise.
|
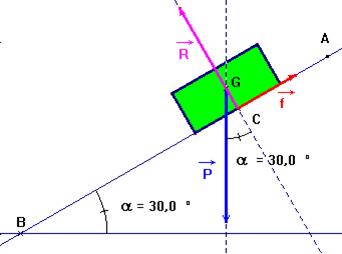
Au service de tri des bagages d’un aéroport,
une valise de masse m = La valise glisse vers le bas à vitesse constante.
On donne : g = 9,8 N /
kg |