|
Contrôle N° 02 |
Correction |
|
|
|
Rédiger
correctement. L’usage de la calculatrice est autorisé.
I- Mouvement d’un mobile autoporteur.
|
|
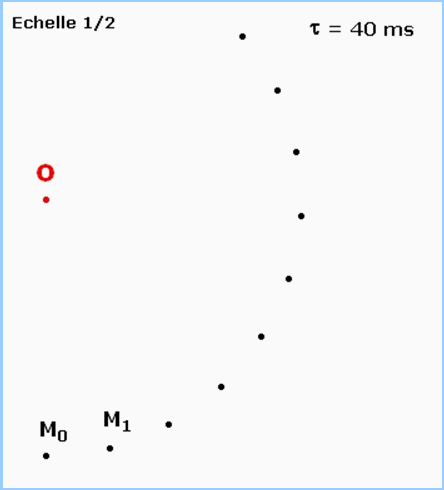
Origine : M2 |
|
Origine : M5 |
|
Direction : Tangent à la trajectoire au point considéré. Ici c'est pratiquement la direction de la droite (M1M3) |
Direction : Tangent à la trajectoire au point considéré. Ici c'est pratiquement la direction de la droite (M4M6) |
||
|
Valeur :
v2
≈ |
Valeur :
v5
≈ |
||
|
Longueur du représentant :
ℓ
v
≈ |
Longueur du représentant :
ℓv
≈ |
|
4)- Les deux vecteurs vitesses sont-ils égaux ? Justifier. - Les deux vecteurs ont la même longueur (la même valeur) mais ils n’ont pas la même direction, le même point d’application,... - Ils sont différents. 5)- Définir et calculer la vitesse angulaire ω du mobile. - On peut définir la vitesse angulaire moyenne que l’on note ω - La vitesse angulaire ω est égale au rapport entre l’angle de rotation α exprimé en rad et la durée du parcours Δt exprimé en seconde.
- Pendant la durée de Δt = 6 τ, l’angle balayé est α = 86,4 °. - En conséquence :
-
6)- Donner la relation liant la vitesse angulaire ω et la vitesse v du mobile. En déduire la valeur de la vitesse angulaire à partir de cette relation. - Relation : Cette relation est valable pour les vitesses instantanées :
- Remarque : tous les points du solide ont à chaque instant la même vitesse de rotation, mais ils n’ont pas généralement la même vitesse instantanée. - Valeur de la vitesse angulaire : -
- Remarque : il y a une différence entre les deux valeurs : -
- Les erreurs sont liées aux mesures effectuées : précisions de l’ordre de demi-millimètre. - Le principe de l’inertie n’est pas respecté. - Le système est en mouvement non rectiligne uniforme. |

|
On prépare un volume V = 250 mL d’une solution mère de chlorure de cuivre II en dissolvant une masse m = 269 mg de chlorure de cuivre CuCℓ2 (s) anhydre dans de l’eau distillée. 1)- Indiquer les différentes étapes de la préparation de la solution et le matériel utilisé. On peut faire des schémas détaillés. - Mode opératoire : schémas détaillés - Matériel : fiole jaugée de 250 mL, coupelle, spatule et balance électronique, - Pissette d’eau distillée, bécher, - On dépose une coupelle sur le plateau de la balance et on appuie sur le bouton tare. - A l’aide d’une spatule, on prélève la quantité nécessaire de chlorure de cuivre II. - On la verse dans une fiole jaugée de 250 mL en utilisant un entonnoir. - On nettoie l’entonnoir et la coupelle avec une pissette d’eau distillée au –dessus de la fiole jaugée. - On ajoute de l’eau distillée au ¾ et on homogénéise. - On complète jusqu’au trait de jauge avec une pissette d’eau distillée et on mélange. - La solution est prête. 2)- Déterminer la quantité de matière n de chlorure de cuivre II dissous en solution. - Quantité de matière n de chlorure de cuivre II dissous en solution : -
3)- Déterminer la concentration molaire C de la solution obtenue. - Concentration molaire C de la solution obtenue -
4)- Ecrire l’équation chimique de la dissolution du chlorure de cuivre II dans l’eau. - Équation chimique de la dissolution du chlorure de cuivre II dans l’eau.
5)-
Déterminer les valeurs des concentrations effectives
[Cu2+ (aq)
]
et
[Cℓ
– (aq)
]
des ions en solution. -
Valeurs des concentrations effectives
[
Cu
2+ (aq)
]
et
[Cℓ
– (aq)
]
des ions en solution. -
[Cu2+
(aq)
]
= C
≈
8,0
x 10 – 3 mol / L et
[Cℓ
–
(aq)
]
= 6)-
On souhaite préparer par dilution, un volume
V F =100 mL d’une solution
fille de chlorure de cuivre
II
de concentration a)- Calculer la valeur du volume V’ de solution mère qu’il faut prélever. Justifier. -
Valeur du volume
V’ de solution mère qu’il
faut prélever et justification. -
On dit qu’au cours d’une dilution, la
quantité de matière de soluté se conserve. -
La solution de départ est appelée la
solution mère et la solution diluée est appelée
la solution fille. - la quantité de matière de soluté présente dans la solution mère :
-
n =
C.V’
(1) - la quantité de matière de soluté présente dans la solution fille :
-
n
F
=
C
F.V
F
(2) -
Avec
n =
n
F. -
b)- Indiquer les différentes étapes de la préparation de la solution fille et le matériel utilisé. On peut faire des schémas détaillés. - Différentes étapes de la préparation de la solution fille et le matériel utilisé : - Matériel : fiole jaugée de 100 mL, pipette jaugée de 10 mL munie de sa propipette, - pissette d’eau distillée, bécher,
-
gants et lunettes (car la solution commerciale est très concentrée). -
Solutions : solution commerciale et
eau distillée. -
On verse un peu d’eau distillée dans la
fiole jaugée (1/2) -
On verse un peu de solution commerciale dans
un bécher. -
On prélève 10 mL de cette solution à l’aide
de la pipette jaugée (10 mL)
munie de sa propipette. -
On les verse dans la fiole jaugée de 100
mL. - On ajoute de l’eau au ¾ et on homogénéise. - On complète jusqu’au trait de jauge avec une pissette d’eau distillée et on mélange.
-
La solution est prête. |