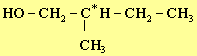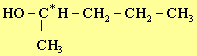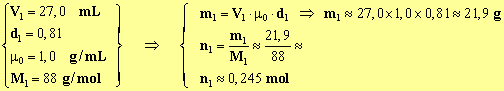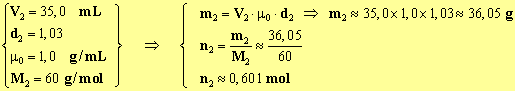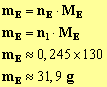|
|
Baccalauréat
Blanc
|
I- Arôme de banane.
L’acétate (ou éthanoate de 3-méthylbutyle (acétate d’isoamyle) est un ester
qui peut être utilisé comme arôme de banane. II- Made opératoire.1)- Dans un ballon, mélanger 27,0 mL de 3-méthylbutan-1-ol, 35,0 mL d’acide acétique et 2 mL d’acide sulfurique.2)-
Ajouter dans le mélange quelques grains de pierre ponce. 3)-
Chauffer à reflux pendant 1 h. 4)- Refroidir le ballon et verser le mélange dans une ampoule à décanter.
Laisser
décanter. On observe deux phases. Éliminer la phase aqueuse. 5)- Dans l’ampoule, ajouter à la phase organique une solution saturée d’hydrogénocarbonate de sodium. Il y a effervescence.
Laisser décanter et
éliminer la phase aqueuse. 6)- On place dans un bécher sec la phase organique à laquelle on ajoute 4 à 5 spatules de sulfate de magnésium anhydre.7)-
Filtrer et recueillir la phase organique. III- Données.
Masses molaires atomiques :
M(C) = 12,0 g / mol ; M(H) =
1,0 g / mol ; M(O) = 16,0 g / mol.
Masse volumique de l’eau :
ρ0
= 1 g / mL. IV- Questions.1)-
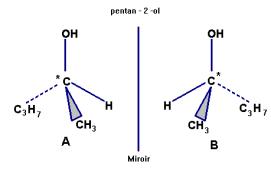
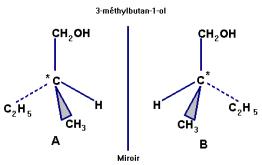
Donner la formule semi-développée d’un isomère du 3-méthylbutna-1-ol possédant
deux énantiomères.
Les représenter. 2)-
Écrire l’équation bilan en formules semi-développées de la réaction d’estérification. 3)- Calculer la masse de chacun des réactifs et la quantité de matière correspondante.
L’un des réactifs est en excès. Lequel ? 4)-
Quel est l’intérêt du chauffage à reflux ? 5)-
Quel est le rôle de l’acide sulfurique ? 6)-
Lors de chaque décantation, où se trouve située la phase organique par rapport à la phase aqueuse ? 7)- L’ion hydrogénocarbonate HCO3– est la base faible du couple CO2, H2O / HCO3–.
À quoi sert l’addition de la solution d’hydrogénocarbonate de sodium ?
quel gaz se dégage lors de
cette addition ? 8)-
Avec les quantités de réactifs utilisées, quelle masse d’ester obtiendrait-on
si la réaction était quasi totale ? 9)-
Après purification, on obtient 25,8 mL d’ester. Quel est le rendement de la
manipulation ? 10)-
Comment pourrait-on augmenter le rendement ?
IV- Questions. 1)- formule semi-développée d’un isomère du 3-méthylbutna-1-ol possédant deux énantiomères. L’alcool doit posséder un carbone asymétrique : voici deux exemples. Il en existe d’autres.
2-méthylbutan-1-ol ou
pentan-2-ol. Représentation de CRAM des énantiomères:
2)- Équation bilan en formules semi-développées de la réaction d’estérification.
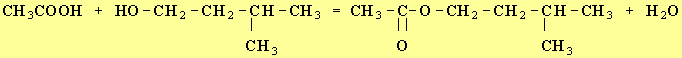
3)- Masse et quantité de matière de chacun des réactifs Alcool isoamylique :
Acide acétique :
Réactifs en excès : D'après le bilan de quantité de matière de la réaction d'estérification, il y a un excès d'acide éthanoïque car n2 > n1. 4)- intérêt du chauffage à reflux : En chauffant, on accélère la réaction d’estérification qui est une réaction lente. Le chauffage à reflux permet de condenser les vapeurs des réactifs et des produits dans le réfrigérant et de les faire retourner à l'état liquide dans le ballon. 5)- rôle de l’acide sulfurique : il fournit les ions H3O+ qui catalysent la réaction.Ils accélèrent la réaction, ils augmentent la vitesse de la réaction. 6)- phase organique et phase aqueuse : La phase organique est constituée principalement par l’ester (d = 0,87) et la phase aqueuse par l’eau (d = 1). L’ester étant peu miscible avec l’eau et moins dense que l’eau, la phase organique se trouve au-dessus de la phase aqueuse. 7)- L’ion hydrogénocarbonate HCO 3–L'hydrogénocarbonate de sodium est une solution basique, elle neutralise le milieu réactionnel et élimine l'acide éthanoïque restant en le solubilisant dans l'eau sous forme d'ions éthanoate. Il se dégage du dioxyde de carbone : CO2.
HCO3 – (aq) + CH3COOH (aq) → CH3COO– (aq) + (CO2 , H2O) (aq)
8)- masse d’ester obtenu si la réaction était totale : On raisonne par rapport au réactif limitant : L’alcool isoamylique.
9)- rendement de la manipulation :
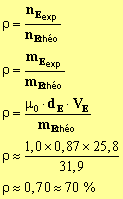
10)- Augmentation du rendement : On peut ajouter de l’acide acétique pour déplacer l’équilibre dans le sens de l’estérification. On peut éliminer l’eau par distillation fractionnée et déplacer ainsi l’équilibre dans le sens de l’estérification. |