|
Quantité de matière. Correction. |
|
|
Programme 2010 : Programme 2020 : |
|
|
|
I - Détermination de la quantité de matière contenue dans un échantillon de corps pur. II - Préparation d'un échantillon contenant une quantité de matière donnée. |
|
Matériel : |
|
|
Prof |
Morceau de craie (calcaire) – chlorure de sodium
deux balances électroniques |
|
élèves : |
Objet en fer – clou bien décapé – lame de plomb
morceau de sucre. Béchers – éprouvette graduée de 25 mL
Solution de sulfate de cuivre II. |
I-
Détermination de la quantité
de matière contenue dans un échantillon de corps pur.![]()
1)-
Notions de bases.
- Qu’appelle-t-on quantité de matière d’un corps pur ? Comment
note–t-on cette grandeur ?
quelle
est son unité ?
|
- La mole est la réunion d'un nombre déterminé d’entités
chimiques toutes identiques. - Une quantité de référence a été choisie arbitrairement. -
Elle est donnée par le Journal officiel du 23 décembre 1975. - On note : NA le nombre d’entités dans un paquet. - Un tel paquet porte le nom de mole. -
La mole est une
unité de
quantité de matière de symbole : mol. |
- Que représente la masse molaire d’une espèce chimique ? Comment
la note-t-on ?
|
- La
masse molaire d’une espèce chimique est la masse d’une mole de
cette espèce chimique. - On symbolise la masse molaire par M. -
La masse molaire s’exprime en g / mol. |
- Quelle relation existe-t-il entre la quantité de matière, la masse et la
masse molaire ?
|
-
Écriture symbolique :
Relations :
|
2)-
Détermination d’une quantité de matière.
- Les mesures de masse se feront à la balance électronique.
- Les mesures de volume de liquide seront faites à l’aide d’une éprouvette graduée.
- On veut déterminer la quantité de matière contenue dans :
|
un objet en fer, |
![]() Proposer un protocole opératoire.
Proposer un protocole opératoire.
|
Exemple pour du sucre ou du sel en poudre |
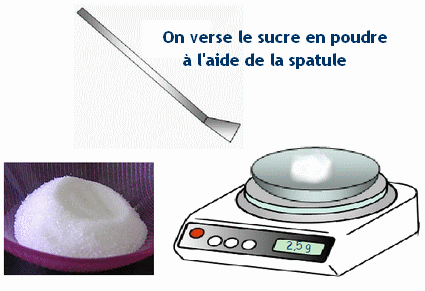 |
|
Pour un objet, il suffit de le poser sur la capsule (ou coupelle) |
![]() Reproduire et compléter le tableau suivant :
Reproduire et compléter le tableau suivant :
|
échantillon |
Formule
brute |
Masse
en g |
Masse molaire
en g / mol |
Quantité de matière
en mol |
|
Objet en fer |
Fe |
|
|
|
|
Morceau
de craie |
|
|
|
|
|
Lame de
plomb |
Pb |
|
|
|
|
Morceau
de sucre |
C12H22O11 |
|
|
|
|
Gros
sel |
|
|
|
|
ʘInformations : rechercher les valeurs des masses molaires dans la classification périodique.
- On donne :
- Le gros sel est du chlorure de sodium : NaCl.
- La craie du carbonate de calcium Ca CO3.
- La formule du sucre
utilisé : C12H22O11.
![]() Indiquer quels sont les corps purs simples (CPS) et les corps purs
composés (CPC).
Indiquer quels sont les corps purs simples (CPS) et les corps purs
composés (CPC).
|
échantillon |
Formule brute |
Masse en g |
Masse molaire en g / mol |
Quantité de matière en mol |
CPS |
CPC |
|
Objet en fer |
Fe |
|
|
|
x |
|
|
Morceau de craie |
|
10,2 |
106 |
|
|
x |
|
Lame de plomb |
Pb |
131 |
|
0,633 |
x |
|
|
Morceau de sucre |
C12H22O11 |
2,4 |
|
|
|
x |
|
Gros
sel |
|
9,6 |
|
|
|
x |
II-
Préparation d’un échantillon contenant une
quantité de matière donnée.![]()
1)-
En mesurant la masse.
![]() Calculer la masse molaire de la molécule d'eau.
Calculer la masse molaire de la molécule d'eau.
- Masse molaire de la molécule d'eau :
- M ( H2O) = M (O) + 2 M (H)
- M ( H2O) ≈ 1 × 16,0 + 2 x 1,0
- M ( H2O) ≈ 18 g / mol
![]() Proposer un protocole opératoire permettant de verser une mole d’eau
dans un bécher.
Proposer un protocole opératoire permettant de verser une mole d’eau
dans un bécher.
|
Une méthode pour l'eau |
|
|
 |
|
Verser jusqu'à ce que la balance affiche 18,0 g |
![]() Réaliser le protocole proposé.
Réaliser le protocole proposé.
- Verser le liquide dans une éprouvette graduée et noter le volume
V
d’eau correspondant.
|
Utilisation d'une éprouvette graduée de 50 mL |
|
|
|
Volume d'une mole d'eau : V = 18,0 mL |
![]() En déduire la masse volumique de l’eau.
En déduire la masse volumique de l’eau.
- Masse volumique de l'eau :
- 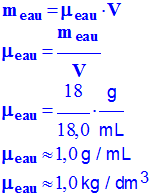
2)-
En mesurant le volume.
- Déterminer le volume d’acétone
V qu’il faut prélever pour obtenir une
quantité de matière de 0,30 mol.
- On donne : formule brute de l’acétone :
C3H6O et sa masse volumique :
μ ≈
- Volume d'acétone :
- 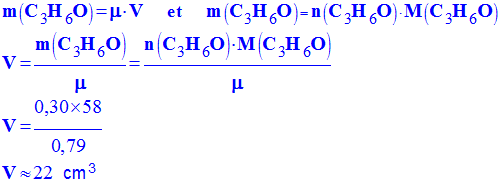
III-
Vérification
de la loi de Lavoisier.![]()
1)-
Peser un bécher contenant une solution de sulfate de cuivre
II et un clou
bien décapé, placée côte à côte sur le plateau d’une balance.
2)-
Mettre le clou dans le bécher.
- L’équilibre est-il conservé ?
- Noter les modifications de l’aspect du clou, de la solution.
- Indiquer avec une phrase la réaction chimique qui se produit.
- La loi de Lavoisier est-elle vérifiée ? Justifier.