|
TP Chimie N° 07 |
Analogies dans la famille des Halogènes. Correction |
|
|
|
|
Programme 2010 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
I - Dissolution des corps purs
simples.
3)- Dissolution dans un solvant
organique.
II - Étude des corps purs
composés.
3)- Actions des ions argent sur les
ions halogénures. |
Matériel :
|
Prof |
Dichlore,
dibrome, diiode, solution aqueuse de dichlore, dibrome et diiode. KCl, KBr
et KI solides. |
|
élèves : |
Solutions aqueuses diluées de dichlore, dibrome et diiode. Heptane (solvant organique), solution aqueuse de nitrate d’argent, et de nitrate de plomb.
Solutions aqueuses de chlorure de potassium, de bromure de potassium et
d’iodure de potassium.
Tubes
à essais, goupillon, |
Données :
|
|
Dibrome |
Dichlore |
Diiode | ||||
|
Inflammable |
|
|
|
|
|
| |
|
Corrosive |
|
|
| ||||
|
Nocive ou irritante |
|
|
| ||||
|
Toxique |
|
|
| ||||
|
Aspect |
|
Liquide brun - rouge |
|
Gaz jaune
- vert |
|
Solide violet foncé | |
|
Température d’ébullition |
|
58,7 °
C |
|
- 34 °
C |
|
183 °
C | |
|
Température de fusion |
|
- 7,2 °
C |
|
- 101 °
C |
|
114 °
C | |
|
Solubilité dans l’eau |
|
35,5 g /
L |
|
7,3 g /
L |
|
0,3 g /
L | |
|
Risque de pollution pour |
L’air |
|
Masse
molaire : 159,8 g /
mol |
|
Masse
molaire : 70,9 g /
mol |
|
Masse
molaire : 253,8 g /
mol |
|
L’eau |
|
Masse Volumique : 3119 kg /
m3 |
|
Masse Volumique : 3,00 kg /
m3 |
|
Masse Volumique : 4930 kg /
m3 | |
|
Le
sol |
|
Densité :
3,119 |
|
Densité :
2,49 |
|
Densité :
4,93 | |
I-
Dissolution
des corps purs simples.
![]() Donner la formule brute et le
nom des molécules obtenues à partir des halogènes.
Donner la formule brute et le
nom des molécules obtenues à partir des halogènes.
- Présentation : observer les flacons contenant les trois dihalogènes. Faire les schémas.
- Préciser le nom, les formules, les teintes, l’état physique et la toxicité des différents dihalogènes.
|
Nom |
Le
dichlore |
Le
dibrome |
Le
diiode |
|
Formule |
Cl2 |
Br2 |
I2 |
|
Présentation |
|
|
|
|
État
physique |
Gaz de couleur
vert-pâle |
Liquide
brun-rouge |
Solide
violet foncé |
|
Toxicité |
Toxique |
Toxique
et corrosif |
Nocif,
irritant |
|
Additif |
|
|
|
- Le dichlore, le dibrome et le diiode sont peu solubles dans l’eau.
![]() Faire les schémas des flacons
contenant les solutions aqueuses des dihalogènes et donner les caractéristiques
des différentes solutions.
Faire les schémas des flacons
contenant les solutions aqueuses des dihalogènes et donner les caractéristiques
des différentes solutions.
|
Solution aqueuse de dichlore |
Solution aqueuse de dibrome |
Solution aqueuse de diiode |
|
|
|
|
3)- Dissolution dans un solvant organique : l’heptane.
a)- Expérience 1 :
![]() Première
étape : Prendre 3 tubes à essais
A,
B,
C.
Première
étape : Prendre 3 tubes à essais
A,
B,
C.
- Tube A : Verser environ 2 mL d’une solution aqueuse de dichlore.
- Tube B : verser environ 2 mL d’une solution aqueuse de dibrome.
- Tube C : verser environ 2 mL d’une solution aqueuse de diiode.
![]() Faire un schéma légendé de
chaque tube et indiquer les observations.
Faire un schéma légendé de
chaque tube et indiquer les observations.
|
|
|
|
![]() Deuxième
étape :
Deuxième
étape :
- Dans chaque tube à essais, ajouter délicatement 1 mL d’heptane (solvant organique).
![]() Faire un schéma légendé de
chaque tube et indiquer les observations. Préciser la teinte de chaque
phase.
Faire un schéma légendé de
chaque tube et indiquer les observations. Préciser la teinte de chaque
phase.
- Quelle conclusion peut-on tirer ?
|
Tube
A |
Tube
B |
Tube
C |
|
|
|
|
|
Les solutions aqueuses de dichlore, dibrome et de diiode ne se mélangent pas avec la solution d’heptane (non miscible). L’heptane est moins dense que les différentes solutions aqueuses
(il se trouve au-dessus des différentes
solutions aqueuses). |
||
![]() Troisième étape :
Troisième étape :
- Boucher chaque tube, agiter puis laisser reposer.
![]() Faire un schéma légendé,
indiquer la teinte et la position de chaque phase. Décrire le phénomène
observé.
Faire un schéma légendé,
indiquer la teinte et la position de chaque phase. Décrire le phénomène
observé.
- Conclusion.
|
Tube
A |
Tube
B |
Tube
C |
|
|
|
|
|
- Le dichlore, le dibrome et le diiode sont plus soluble
dans l’heptane que dans
l’eau. |
||
- Exemple : cas de la solution aqueuse de diiode en photos.
|
- Première étape :
- On verse délicatement l’heptane (liquide incolore) dans le tube à essais contenant la solution aqueuse de diiode. - Deuxième étape :
- On remarque que l’heptane est moins dense que la solution aqueuse de diiode (l'heptane se situe au-dessus de l’autre solution). - Les deux solutions sont non miscibles (elles ne se mélangent pas) - Troisième étape :
- Après agitation et décantation, on remarque qu’une grande partie du diiode est passée de la phase aqueuse (solution aqueuse) à la phase organique (heptane). - Le diiode est plus soluble dans l’heptane que dans l’eau. - D’où provient la coloration violette : - La solution a la même couleur que le diiode gazeux.
|
II-
Étude
des corps purs composés contenant un alcalin et un halogène : KCl, KBr et
KI.
- Observer du chlorure de potassium, du bromure de potassium et de l’iodure de potassium.
- Quelles sont les remarques que l’on peut faire ?
|
Le chlorure de potassium, le bromure de potassium et l’iodure
de potassium sont des solides blancs.
|
2)- Dissolution dans l’eau.
- La solubilité de ces composés dans l’eau est très grande.
- Que peut-on dire des solutions obtenues ? Que contiennent-elles ?
|
- Lorsque l’on dissout le chlorure de potassium, le bromure de potassium et l’iodure de potassium dans l’eau.
-
On obtient des
liquides homogènes incolores - Les solutions obtenues contiennent des ions. On parle de solutions ioniques ou d’électrolytes.
- Elles conduisent le courant électrique.
-
La solution de
chlorure de potassium contient les ions chlorure
Cl
–
et
les ions potassium K+.
-
La solution de
bromure de potassium contient les ions bromure
Br
–
et
les ions potassium K+. - La solution d’iodure de potassium contient les ions iodure I – et les ions potassium K+.
|
3)- Action de l’ion argent Ag+ sur les ions halogénures (Cl –, Br –, I –)..
- Expérience 2.
![]() Prendre 3
tubes à essais
A,
B,
C.
Prendre 3
tubes à essais
A,
B,
C.
- Tube A : Verser environ 2 mL d’une solution aqueuse de chlorure de potassium
- Tube B : verser environ 2 mL d’une solution aqueuse de bromure de potassium
- Tube C : verser environ 2 mL d’une solution aqueuse d'iodure de potassium.
- Ajouter
dans chaque tube quelques gouttes d’une solution aqueuse de nitrate
d’argent.
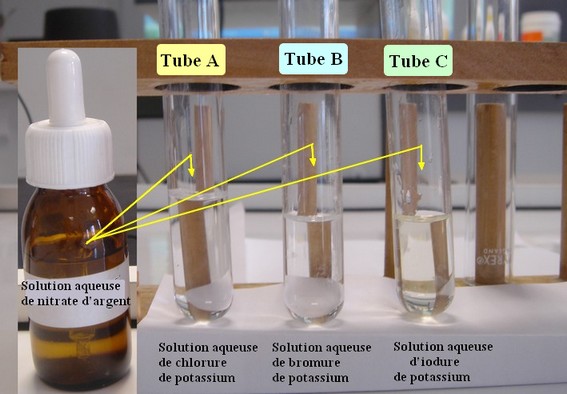
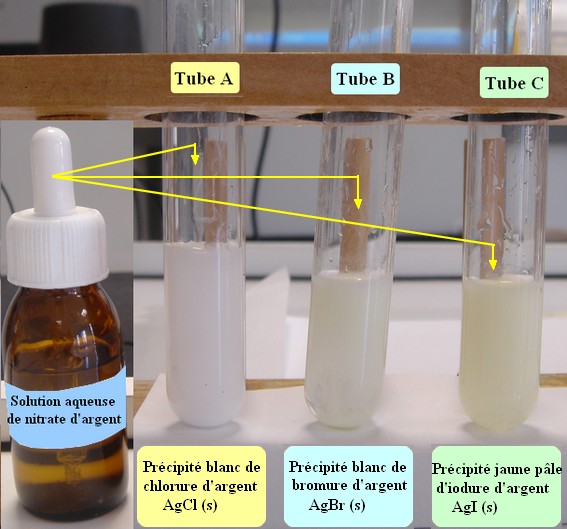
![]() Faire un schéma légendé de chaque
tube et indiquer les observations.
Faire un schéma légendé de chaque
tube et indiquer les observations.
- Donner les ions présents dans chaque tube.
- Écrire les équations bilans des réactions de précipitation.
- Exposer les tubes en pleine lumière. Remarque. Conclusion.
|
Tube
A |
|
|
|
Ag+
(aq)
+
Cl–
(aq) →
AgCl
(s) |
|
Tube
B |
|
|
|
Ag+
(aq)
+
Br
–
(aq) →
AgBr
(s) |
|
Tube
C |
|
|
|
Ag+ (aq)
+
I
–
(aq)
→
AgI
(s) |
4)- Action de l’ion plomb Pb 2+ sur les ions halogénures (Cl –, Br –, I –).
- Expérience 3.
![]() Prendre 3
tubes à essais
A,
B,
C.
Prendre 3
tubes à essais
A,
B,
C.
- Tube A : Verser environ 2 mL d’une solution aqueuse de chlorure de potassium
- Tube B : verser environ 2 mL d’une solution aqueuse de bromure de potassium
- Tube C : verser environ 2 mL d’une solution aqueuse d'iodure de potassium.
- Ajouter
dans chaque tube quelques gouttes d’une solution aqueuse de nitrate de plomb
II.

![]() Faire un schéma légendé de
chaque tube et indiquer les observations.
Faire un schéma légendé de
chaque tube et indiquer les observations.
- Donner les ions présents dans chaque tube.
- Écrire les équations bilans des réactions de précipitation.
- Exposer les tubes en pleine lumière. Remarque. Conclusion.
|
Tube
A |
|
|
|
Pb
2+ (aq) +
2
Cl–
(aq)
→
PbCl2
(s) |
|
Tube
B |
|
|
|
Pb2+ (aq) +
2
Br–
(aq)
→
PbBr2
(s) |
|
Tube
C |
|
|
|
Pb2+ (aq)
+ 2 I–
(aq) →
PbI2 (s) |
|
-
Le chlore, le brome et l’iode donnent la formation de
molécules diatomiques.
-
L’état physique des molécules est lié à la position de l’élément
dans la classification périodique, à la ligne qu’il occupe
-
Ils donnent la formation d’ions négatifs mono-chargés :
anions monoatomiques.
-
On remarque qu’ils possèdent des propriétés chimiques
analogues. - Ces éléments appartiennent à la même colonne, de ce fait ils constituent une famille :
-
la famille des halogènes. |