|
|
|
TP Chimie. N° 11 |
Nomenclature. Correction. |
|
|
Logiciel pour la construction de molécule |
Gratuit |
1)- Définitions.
- Les hydrocarbures sont des composés organiques dont la molécule ne contient que des atomes de carbone C et d’hydrogène H.
- Les alcanes sont des hydrocarbures saturés.
- Leurs atomes de carbones sont tétragonaux.
- La formule générale d’un alcane non cyclique est : CnH 2n+2.
- Les cycloalcanes sont des alcanes à chaîne cyclique.
- La formule générale d’un alcane cyclique est : CnH 2n.
2)- Nomenclature des alcanes.
- Les quatre premiers alcanes ont un nom consacré par l'usage : méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10).
- Pour les autres alcanes à chaîne linéaire, on utilise un préfixe grec indiquant le nombre d'atomes de carbone que l'on fait suivre du suffixe -ane.
- Le tableau ci-dessous donne les préfixes des alcanes de n = 5 à n = 18.
|
Nombre d'atomes de carbone :
n |
Formule |
Préfixe |
Nom
|
|
5 |
C5H12 |
pent- |
pentane |
|
6 |
C6H14 |
hex- |
hexane |
|
7 |
C7H16 |
hept- |
heptane |
|
8 |
C8H18 |
oct- |
octane |
|
9 |
C9H20 |
non- |
nonane |
|
10 |
C10H22 |
déc- |
décane |
|
11 |
C11H24 |
undéc- |
undécane |
|
12 |
C12H26 |
dodéc- |
dodécane |
|
13 |
C13H28 |
tridéc- |
tridécane |
|
14 |
C14H30 |
tétradéc- |
tétradécane |
|
15 |
C15H32 |
pentadéc- |
pentadécane |
|
16 |
C16H34 |
hexadéc- |
hexadécane |
|
17 |
C17H36 |
heptadéc- |
heptadécane |
|
18 |
C18H38 |
octadéc- |
octadécane |
- Les groupements alkyles.
- Un alcane non cyclique peut s'écrire : CnH2n+1 – ; ou R – ;
- R – est un groupement alkyle.
- On obtient un groupement alkyle en enlevant un atome d'hydrogène à la formule d'un alcane.
- Exemples :
|
Groupe méthyle |
CH3– |
|
Groupe éthyle |
CH3 – CH2 – |
|
Groupe propyle |
CH3 – CH2 – CH2 – |
|
Groupe isopropyle ou Méthyléthyle |
|
|
Alcanes à chaîne carbonée ramifiée. On obtient le nom de l'alcane de la manière suivante : On cherche la chaîne carbonée la plus longue et le nom de l'alcane à chaîne linéaire comportant le même nombre d'atomes de carbone.
L'alcane considéré est nommé comme un dérivé de cet alcane
linéaire.
La chaîne la plus longue s'appelle la
chaîne principale. On identifie les groupes substituants sur cette chaîne et leur place par un indice de position. Cet indice s'obtient grâce à la numérotation des atomes de carbone de la chaîne principale. Deux sens de numérotation existent, Pour trouver le bon sens de numérotation : On écrit tous les indices obtenus par ordre croissant. Le sens à retenir est celui pour lequel le premier chiffre différent est le plus petit. Ou bien, on choisit celui pour lequel la somme des indices est la plus petite. Dans l'écriture du nom de l'alcane, on doit respecter deux règles : Les indices de position des groupes alkyles se placent devant le nom du groupe. Les groupes alkyles s'écrivent avant le nom de l'alcane. Deux chiffres sont séparés par une virgule et entre un chiffre et une lettre, on place un tiret. On fait élision du "e" du nom de l'alkyle. Les groupements alkyles sont placés par ordre alphabétique. S'il existe
plusieurs groupes identiques, en utilise les préfixes :
di, tri, tétra… Les substituants halogènes se traitent comme les groupes alkyles. |
3)- Applications1.
a)- Représenter et nommer les molécules A, B, C.
|
|
|
|
A 4-éthyl-2méthylheptane |
B 2 ,5-diméthylhexane |
|
|
|
|
C 5-éthyl-2,2-diméthyloctane |
|
b)- Correction :
- Pour corriger, on utiliser le logiciel Nomenclature 3.
- Lancer le logiciel Nomenclature 3 (menu démarrer, sélectionner chimie puis Nomenclature 3).
- Sélectionner : Interroger,
- Puis formule nom :

- Choisir le nombre de carbone de la chaîne carbonée la plus longue.

- Puis identifier et placer les substituants.

- Vérification :



- Entrer le nom trouvé et comparer.
4)- Application 2.
- Écrire la formule développée des composés suivants :
|
Diméthylpropane |
D |
2,4-diméthylpentane |
F |
|
3-éthylpentane |
E |
Méthylbutane |
G |
|
D Diméthylpropane |
F 2,4-diméthylpentane |
|
|
|
|
E 3-éthylpentane |
G Méthylbutane |
|
|
|
- Vérification : construire la molécule et vérifier le nom avec le logiciel.
1)- Définition.
- Les alcènes sont des hydrocarbures insaturés, non cycliques, qui possèdent une double liaison carbone - carbone C = C.
- Leur formule brute générale : CnH2n.
- Remarque :
- Les atomes de carbone de la double liaison sont trigonaux.
2)- Nomenclature.
a)- Nomenclature :
Le suffixe -ène caractérise les alcènes. On obtient le nom d'un alcène de la manière suivante : On cherche la chaîne carbonée la plus longue contenant la double liaison. On compte le nombre d'atomes de carbone de cette chaîne principale et on obtient le nom de l'alcène grâce au préfixe grec indiquant le nombre d'atomes de carbone suivi du suffixe -ène. On numérote les atomes de carbone de la chaîne principale de façon à avoir les plus petits indices pour les atomes de carbone doublement liés. La place de la double liaison est indiquée par son indice de position placé avant le suffixe - ène. C'est la place de la double liaison qui impose le sens de numérotation. Comme pour les alcanes, on indique les groupes substituants de la chaîne principale avec leur indice de position. |
b)- L’isomérie Z et E ou stéréo-isomérie.
- Autour d’une simple liaison carbone – carbone C – C,
- Il y a libre rotation alors qu’il n’existe pas de libre rotation autour d’une double liaison carbone - carbone C = C.
- Exemple :
- Que peut-on dire des molécules suivantes ? Les nommer.
|
Molécule A
But-2-ène |
Molécule
B
But-2-ène |
- Les molécules A et B différent par la position, par rapport à l’axe de la double liaison, des deux atomes d’hydrogène.
- Les deux molécules ne sont pas superposables.
- Pour passer de la molécule A à la molécule B, il faut rompre certaines liaisons et en reformer d’autres.
- Il n’y a pas libre rotation autour d’une double liaison carbone - carbone C = C.
- Les molécules A et B sont des molécules distinctes que l’on peut séparer.
- La température d'ébullition normale du (Z)-but-2-ène est de
- Les molécules A et B sont des stéréo-isomères.
|
On dit que le but-2-ène existe dans deux configurations : la configuration Z (de l'allemand zusammen: ensemble) où les deux atomes d’hydrogène sont situés du même côté de la double liaison, et la configuration E (de l'allemand entgegen: opposé) où les deux atomes d’hydrogène sont situés de part et d'autre de la double liaison. |
|
Définition : Si, dans un alcène de formule générale CHX = CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est Z, dans le cas contraire, il est E. |
|
stéréo-isomère
E Entgegen |
stéréo-isomère
Z Zusammen |
- Cas du but-2-ène :
|
(Z)But-2-ène |
(E)But-2-ène |
3)- Application 1.
|
|
|
|
H Pent-1-éne |
I (Z)-pent-2-éne |
|
|
|
|
J (E)-pent-2-éne |
K 2,3-dimethylbut-2-éne |
- Remarque :
- On peut construire les molécules avec le logiciel Nomenclature, mais on ne peut pas développer la double liaison (le logiciel a ses limites).
- On peut utiliser le logiciel ChemSkech.
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
(Z)-hex-2-ène |
L |
(E)-4-méthylpent-2-ène |
N |
|
2-méthylpent-2-ène |
M |
2,3-diméthylbut-2-ène |
O |
|
L
(Z)-hex-2-ène |
N
(E)-4-méthylpent-2-ène |
|
|
|
|
M
2-méthylpent-2-ène |
O
2,3-diméthylbut-2-ène |
|
|
|
1)- Définition.
- On appelle alcool tout composé organique possédant un groupe hydroxyle – OH lié à un atome de carbone tétragonal.
- Formule générale d’un alcool : R – OH.
- On distingue :
|
Les alcools primaires |
Les alcools secondaires |
Les alcools tertiaires |
|
R – CH 2 – OH R – CH2OH ou
L’atome de carbone fonctionnel n’est lié qu’à des atomes d’hydrogèneou à un seul atome de carbone |
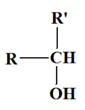 L’atome de carbone fonctionnel est lié à deux atomes de carbone |
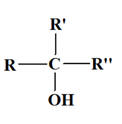 L’atome de carbone fonctionnel est lié à trois atomes de carbone |
2)- Nomenclature.
|
Le nom d'un alcool dérive de celui de l'alcane de même squelette carboné On cherche la chaîne carbonée la plus longue contenant l’atome de carbone qui porte le groupe hydroxyle – OH. On met en place la numérotation qui donne à cet atome de carbone l’indice le plus petit. On nomme l’alcool grâce au nom de l’alcane correspondant à cette chaîne avec élision du e final que l’on fait suivre du suffixe ol affecté de l’indice de position qui lui correspond. |
3)- Applications 1.
- Reproduire et nommer les molécules suivantes : préciser la classe de chaque alcool
|
|
|
|
P
2,3-diméthylbutan-1-ol Alcool Primaire |
Q
2-méthylpropan-1-ol Alcool Primaire |
|
|
|
|
R
2-méthylpropan-2-ol Alcool Tertiaire |
S
2,3-diméthylpentan-3-ol Alcool Tertiaire |
- Faire la vérification.
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
2-éthylbutan-1-ol |
T |
2-méthylpropan-2-ol |
V |
|
Méthanol |
U |
2,3-diméthylbutan-1-ol |
W |
|
T
2-éthylbutan-1-ol |
V
2-méthylpropan-2-ol |
|
|
|
|
U
Méthanol |
W
2,3-diméthylbutan-1-ol |
|
CH 3 – OH |
|
1)- Définition.
- Les aldéhydes et les cétones sont des composés carbonylés. Ils possèdent le groupe caractéristique :
|
|
|
|
Groupe
carbonyle |
aldéhydes |
- Le carbone fonctionnel est trigonal.
2)- Nomenclature.
Le nom d'un aldéhyde dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison al. Le carbone fonctionnel est toujours en bout de chaîne et porte le numéro 1. Le méthanal : Gazeux à la température ordinaire. La solution à 37 % dans l'eau, donne le formol qui permet la conservation des spécimens et sert à la fabrication de la bakélite et du formica. Éthanal : acétaldéhyde ou aldéhyde acétique a une odeur de
pomme (θeb =
Il sert à la fabrication de l'acide éthanoïque ou acide acétique. |
3)- Applications 1.
- Reproduire et nommer les molécules suivantes, puis faire la vérification.
|
|
|
|
X Pentanal |
Y 2,3-diméthylbutanal |
|
|
|
|
Z
2,2-diméthylpropanal pivalaldehyde |
A1
2,2-dimethylbutanal |
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
2,2-diméthylbutanal |
B1 |
Éthanal |
D1 |
|
Méthanal |
C1 |
2-éthylbutanal |
E1 |
|
B1
2,2-diméthylbutanal |
D1
Éthanal
acétaldehyde |
|
|
|
|
C1
Méthanal formaldéhyde |
E1
2-éthylbutanal |
|
|
|
1)- Définition.
- Les aldéhydes et les cétones sont des composés carbonylés.
- Ils possèdent le groupe caractéristique :
|
|
|
|
Groupe
carbonyle |
Cétones |
- Le carbone fonctionnel est trigonal.
2)- Nomenclature.
Le nom d'une cétone dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison one précédée de la position du groupe carbonyle dans la chaîne principale. Le carbone fonctionnel ne peut pas être en bout de chaîne. L'acétone : propanone sert comme solvant (dissolvant pour le rouge à ongle). |
3)- Applications 1.
- Reproduire et nommer les molécules suivantes, puis faire la vérification.
|
|
|
|
F1 3-methylbutan-2-one |
G1 butan-2-one |
|
|
|
|
H1 2,4-diméthylpentan-3-one |
I1 3,3-dimethylbutan-2-one |
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
Pentan-2-one |
J1 |
Propanone |
L1 |
|
3-méthylbutan-2-one |
K1 |
3-propylhexan-2-one |
M1 |
|
J1
Pentan-2-one |
L1 Propanone Acétone |
|
|
|
|
K1
3-méthylbutan-2-one |
M1
3-propylhexan-2-one |
|
|
|
1)- Définition.
- Les acides carboxyliques possèdent en commun le groupe caractéristique : – COOH
|
|
|
R – COOH |
|
Groupe
carboxyle |
Formule
générale |
Autre
formulation |
- Le carbone fonctionnel est trigonal et il est lié à deux atomes d'oxygène.
2)- Nomenclature.
|
Nomenclature : Le nom de l'acide carboxylique dérive de celui de l'alcane de même squelette carboné en remplaçant le e final par la terminaison oïque, le tout étant précédé du mot acide. |
3)- Applications 1.
- Reproduire et nommer les molécules suivantes, puis faire la vérification.
|
|
|
|
N1 Acide
éthanoïque Acide acétique |
O1 Acide 2-méthylpropanoïque |
|
|
|
|
P1 Acide 2-méthylbutanoïque |
Q1 Acide 2,3-diméthylbutanoïque |
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
Acide propanoïque |
R1 |
|
Acide 2-méthylbutanoïque |
S1 |
|
Acide formique |
T1 |
|
Acide acétique |
U1 |
|
Acide propanoïque
|
R1 |
|
Acide 2-méthylbutanoïque
|
S1 |
|
Acide formique
Acide méthanoïque |
T1 |
|
Acide acétique
Acide
éthanoïque |
U1 |
1)- Définition.
- On appelle amine tout composé organique obtenu en remplaçant dans la molécule d’ammoniac NH3, un, deux ou trois atomes d’hydrogène par un, deux ou trois groupes alkyles.
- On distingue les amines primaires, les amines secondaires et les amines tertiaires.
a)- Les amines primaires.
-
Formule générale :
R
–
NH2
b)- Les amines secondaires et tertiaires symétriques.
- Formule générale :
|
Amines secondaires symétriques. R – NH – R
|
Amines
tertiaires symétriques
|
|||||||||||||||
c)- Les animes secondaires et tertiaires non symétriques.
- Formule générale :
|
Animes secondaires non symétrique R – NH – R' |
Animes tertiaires non symétriques.
|
|||||||||||||||
2)- Nomenclature.
a)- Les amines primaires.
- Formule générale :
R
–NH2
Nomenclature : On nomme l’amine à partir du nom de l’alcane R – H correspondant, avec élision du e, que l’on fait suivre de la terminaison amine en précisant la position du groupe – NH2. |
b)- Les amines secondaires et tertiaires symétriques.
Nomenclature : On fait suivre le nom de l’alkyle R – , précédé de di ou tri, de la terminaison amine. |
c)- Les animes secondaires et tertiaires non symétriques.
Nomenclature : On les nomme comme des dérivés de substitution sur l’azote de l’amine R – NH2 où R – est le groupe le plus long. On écrit le ou les groupes substituants sur l’azote dans l’ordre alphabétique, précédés de la lettre N et suivis du nom de l’amine R – NH2. |
3)- Applications 1.
- Reproduire et nommer les molécules suivantes, puis faire la vérification.
|
|
|
|
V1 propan-2-amine |
W1 éthanamine |
|
|
|
|
X1 N-méthyléthanamine |
Y1 N-éthyl-N-méthylpropan-1-amine |
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
N-éthyl-N-méthyléthanamine |
Z1 |
|
diméthyléthanamine |
A2 |
|
N,N-diméthylméthanamine |
B2 |
|
3-méthylbutan-2-amine |
C2 |
|
Z1 N-éthyl-N-méthyléthanamine |
B2 N,N-diméthylméthanamine triméthylamine |
|
|
|
|
A2 N,N-diméthyléthanamine |
C2 3-méthylbutan-2-amine |
|
|
|
VIII- Les composés halogénés ou les halogénures d’alkyle.
1)- Définition.
- On appelle halogénures d’alkyle tout composé organique possédant un atome d’halogène (Cl, Br, I, F) lié à un atome de carbone par une simple liaison.
- Formule générale :
|
R
– X |
R – Cl |
|
R – Br |
|
|
R
– I |
|
|
R
– F |
2)- Nomenclature :
Nomenclature : Leur nom s’obtient en faisant précéder le nom de l’alcane correspondant du préfixe chloro, bromo, iodo ou fluoro, précédé de son indice de position. |
3)- Applications 1 :
- Reproduire et nommer les molécules suivantes, puis faire la vérification :
|
D2 |
|
1-chloropropane
|
|
E2 |
|
1,2,3-trichloropropane
|
|
F2 |
|
3-bromo-1,2-dichlorobutane
|
|
G2 |
|
Trichlorométhane (Chloroforme) |
4)- Application 2.
- Écrire la formule semi-développée des composés suivants, puis faire la vérification.
|
Chloroforme |
H2 |
|
|
Chlorobenzène |
I2 |
|
|
3-bromo-5-chloro-2-iodohexane |
J2 |
|
|
tetrachlorométhane |
K2 |
|