|
Conductance et facteurs d’influence. Enoncé. |
|
|
|
|
Objectifs :
-
;Mesurer
la conductance d’une portion de solution électrolytique.
- Étudier
quelques facteurs influençant la conductance |
|
Matériel : Un G.B.F, deux multimètres (un noir et un jaune), 5 cellules de conductimétrie, des fils de connexion, des béchers, Des solutions : (Na+ + Cl – ) (C1 = 2,0 x 10 – 3 mol / L ; C = 5,0 x 10 – 3 mol / L ; C2 = 1,0 x 10 – 2 mol / L), (Na+ + HO – ) et (H+ + Cl –), (C = 5,0 x 10 – 3 mol / L ). |
|
II- Facteurs influençant la conductance. |
- Dans une solution aqueuse électrolytique, le passage du courant électrique est assuré par le déplacement des ions.
- On s’intéresse au caractère conducteur d’une solution électrolytique.
- Dans certaines conditions, une solution ionique se comporte comme un conducteur ohmique.
- Elle répond alors à
-

- R est une grandeur caractéristique du conducteur.
- Elle rend compte de la capacité de celui-ci à s’opposer au passage du courant (d’où son nom).
- Les chimistes préfèrent étudier l’inverse c’est-à-dire la capacité qu’a la solution électrolytique à laisser passer le courant.
- Ils étudient la conductance G qui est l’inverse de la résistance :
- 
- Loi d’Ohm :
- 
a)- Principe.
- Pour déterminer la valeur de G, on utilise la loi d’Ohm :
-

- Il faut connaître U et I.
- Pour cela, on plonge dans la solution ionique, deux plaques métalliques, appelées électrodes, reliées à un générateur.
- On mesure la tension U entre les électrodes avec un voltmètre.
- On mesure l’intensité I du courant dans le circuit avec un ampèremètre.
- L‘ensemble constitué par les deux plaques métalliques planes et parallèles est appelé : Cellule conductimétrique.
- On détermine ensuite la valeur de la conductance G de la portion de solution ionique comprise entre les électrodes.
b)- Dispositif expérimental :
- Prendre l’électrode S
=
- Schéma :
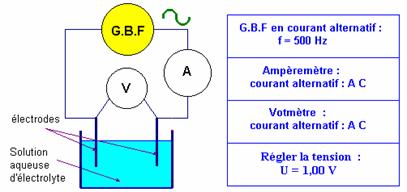
![]() Réaliser le montage et les différents réglages avant de
rincer les électrodes.
Réaliser le montage et les différents réglages avant de
rincer les électrodes.
c)- Mesure :
![]() Rincer les électrodes à l’eau distillée.
Rincer les électrodes à l’eau distillée.
- Éliminer l’eau de rinçage délicatement avec du papier absorbant.
- Agiter doucement la cellule dans la solution pour bien homogénéiser.
- La solution ionique est une solution de chlorure de sodium de concentration :
- C = 5,0 x 10 – 3 mol / L.
- Réaliser une mesure de G.
Animation CabriJava
Cliquer sur l'image pour l'agrandir
II- Facteurs influençant la conductance.
1)- Influence des caractéristiques S et ℓ de la cellule.
- On dispose d’un jeu de cellules conductimétriques.
- On peut faire varier la distance ℓ entre les électrodes et la surface S de leur partie immergée.
a)- Influence de la distance ℓ entre les électrodes.
- Faire une mesure avec
S =
- Comparer la valeur de cette mesure à celle obtenue au I- 2)- c)-. Conclusion.
b)- Influence de S.
- La distance
ℓ entre les électrodes
étant maintenue constante (ℓ =
- Faire une mesure et la comparer à la valeur obtenue au
I- 2)- c)-. (S = 1 cm2 et
ℓ =
2)- Influence des caractéristiques de la solution.
- On utilise la cellule conductimétrique du I- 2)- b)-dont les dimensions sont fixées.
- On peut ainsi mettre en évidence des grandeurs d’influence propres à la solution.
a)- Influence du soluté.
- On dispose de solutions (Na+ + Cl –) ; (Na+ + HO–) ; (H+ + Cl –) de même concentration :
- C = 5,0 x 10 – 3 mol / L.
![]() Réaliser les mesures puis reproduire et compléter le tableau
suivant.
Réaliser les mesures puis reproduire et compléter le tableau
suivant.
|
Solution |
(Na+ + Cl – ) |
(Na+ + HO – ) |
(H+ + Cl – ) |
|
G en mS |
|
|
|
![]() Conclusion.
Conclusion.
b)- Influence de la concentration.
- On dispose de la solution (Na+ + Cl – ) de concentration :
- C1 = 2,0 x 10 – 3 mol / L ; C = 5,0 x 10 – 3 mol / L ; C2 = 1,0 x 10 – 2 mol / L.
![]() Réaliser les différentes mesures, reproduire et compléter le
tableau.
Réaliser les différentes mesures, reproduire et compléter le
tableau.
|
C mmol / L |
2 |
5 |
10 |
|
G mS |
|
|
|
![]() Conclusion.
Conclusion.
c)- Influence de la température.
- Relever la température θ de la solution (Na+ + Cl –) de concentration
- C = 5,0 x 10 – 3 mol / L :
- θ =
- faire chauffer la solution et relever la température θ’ de cette solution.
- θ’ =
- réaliser la mesure et comparer la valeur obtenue à celle du I- 2)- c)-. Conclusion.