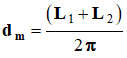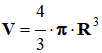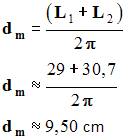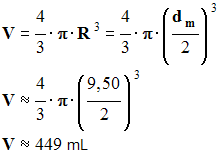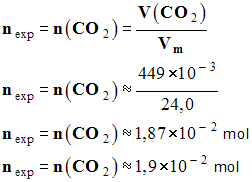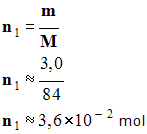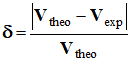|
TP
Chimie N° 01 |
Étude
d’une transformation chimique.
Correction.
|
|
|
Objectifs :
►
Déterminer des quantités de matière
en réactif et produit.
►
Effectuer
une transformation chimique,
►
Identifier un gaz,
► Trouver le réactif limitant
expérimentalement
et par le calcul.
►
Comparer une valeur théorique et une
valeur expérimentale.
|
I-
Aspect qualitatif.
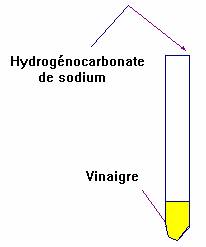
a)- Mode opératoire.
 Dans un tube à essais,
Dans un tube à essais,
- verser 1 mL
environ de vinaigre.
- Préparer un autre tube à essais contenant de l’eau de chaux
pour la caractérisation du gaz.
- Placer à l’aide d’une spatule de l’hydrogénocarbonate de
sodium dans le premier tube à essais.
- Rapidement surmonter l’ensemble d’un tube à dégagement
dont l’extrémité est en contact avec
l’eau de chaux contenue dans le
deuxième tube à essais
b)- Observation et compte rendu.
 Rappeler la formule de l’ion sodium.
Rappeler la formule de l’ion sodium.
 L’hydrogénocarbonate de sodium étant un solide ionique.
L’hydrogénocarbonate de sodium étant un solide ionique.
 Quelle
est la nature et la valeur de la charge électrique de l’ion hydrogénocarbonate ?
Quelle
est la nature et la valeur de la charge électrique de l’ion hydrogénocarbonate ?
 Sachant que ce dernier est formé d’un atome d’hydrogène, d’un
atome de carbone et de trois atomes d’oxygène,
Sachant que ce dernier est formé d’un atome d’hydrogène, d’un
atome de carbone et de trois atomes d’oxygène,
 Donner l’écriture chimique du
solide.
Donner l’écriture chimique du
solide.
|
- Formule de l’ion sodium :
il provient d’un atome de sodium ayant perdu 1 électron.
-
Il porte
la charge (+
e).
|
Na
|
11
|
K (2)
L (8) M(1) |
K (2) L (8) OCTET
|
L’ion
sodium :
Na+
|
- L’ion hydrogénocarbonate :
- Nature de la charge :
-
L’ion hydrogénocarbonate est chargé négativement,
-
Il porte une
charge électrique négative, il porte la charge (–
e).
- Écriture symbolique de l’ion
hydrogénocarbonate :
-
HCO3 –
- Écriture chimique du solide :
-
Formule de l’hydrogénocarbonate de sodium :
-
Na HCO3
|
- Le vinaigre est une solution d’acide éthanoïque de formule
CH3COOH
 Schématiser la transformation chimique et la mise en évidence
du produit formé.
Schématiser la transformation chimique et la mise en évidence
du produit formé.
 Le produit formé peut-il être unique ? Justifier.
Le produit formé peut-il être unique ? Justifier.
 Écrire l’équation bilan de la réaction.
Écrire l’équation bilan de la réaction.
|
- Schémas de la transformation :
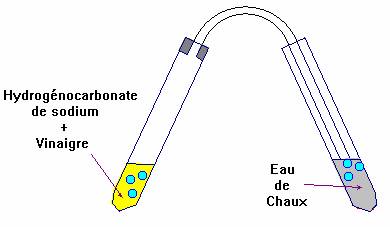
- Le gaz obtenu trouble l’eau
de chaux, c’est du dioxyde de carbone
CO2.
- Le produit formé ne peut pas
être unique car le dioxyde de carbone est formé des éléments
carbone et oxygène,
-
il manque l’élément hydrogène.
- On donne :
-
Le vinaigre à
6 ° est une solution aqueuse d’acide éthanoïque de concentration :
-
C = 1,0 mol / L.
- On note l’acide éthanoïque :
(H
+ + A–
)
- Équation bilan de la réaction :
formulation simplifiée
(H+ + A–
) + Na HCO3 → CO2
+ H2O + (Na+ + A –
)
- On peut donner
la formulation suivante :
CH3COO H + Na HCO3 → CO2 + H2O + (Na+ + CH3COO
–
)
|
II-
Aspect quantitatif.
On
veut déterminer la quantité du gaz qui se dégage par la mesure de son
volume.
a)- Mode opératoire.
 Peser à l’aide d’une balance électronique et d’un verre
de montre environ
3 g
d’hydrogénocarbonate de sodium.
Peser à l’aide d’une balance électronique et d’un verre
de montre environ
3 g
d’hydrogénocarbonate de sodium.
- Noter la valeur
exacte de la masse prélevée :
m
= 3,0 g
- Introduire dans le ballon de baudruche la quantité d’hydrogénocarbonate
pesée à l’aide de l’entonnoir.
- Verser dans le flacon 20 mL de vinaigre à 6 °
- Adapter le ballon à l’orifice du flacon puis faire tomber la
totalité de la poudre du ballon dans le flacon
(Attention : maintenir le
ballon) :
observer.
- Agiter prudemment le flacon jusqu’à ce que l’effervescence cesse.
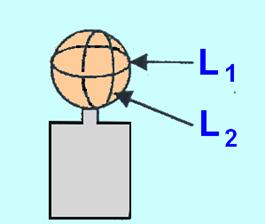
- Mesurer le volume gazeux lorsque la réaction est finie.
- Pour
cela, on assimilera le ballon à une sphère et on déterminera le diamètre
moyen du ballon à partir de la mesure de la circonférence moyenne du ballon
à l’aide d’un fil inextensible :
- On utilisera la relation suivante :
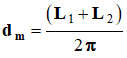 .
.
b)- Compte-rendu.
 Déterminer le volume
vexp de
gaz formé (Volume d’une sphère :
Déterminer le volume
vexp de
gaz formé (Volume d’une sphère :
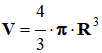 ).
).
|
- Mesures :
- L
1 =
29 cm
et
L
2 =
30.7 cm
- Diamètre moyen du ballon :
- 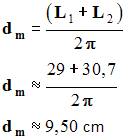
- Volume de gaz formé :
-
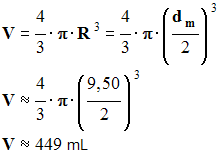
|
 Déterminer la quantité de matière
nexp de
gaz formé.
Déterminer la quantité de matière
nexp de
gaz formé.
-
On prendra :
vm = 24,0 L
/ mol.
|
- Quantité de matière de
dioxyde de carbone formé :
-
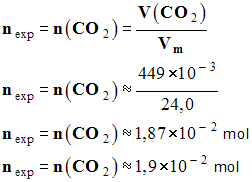
|
 Quel est le réactif limitant lors de l’expérience ?
Justifier par le calcul.
Quel est le réactif limitant lors de l’expérience ?
Justifier par le calcul.
|
- Dans un premier temps, il faut
calculer les quantités de matière de chaque réactif.
- Quantité de matière
d’hydrogénocarbonate de sodium :
-
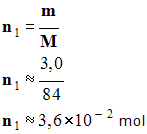
- Quantité de matière
d’acide éthanoïque :
- n2
= C . V
- n2
= 1,0 x 20
x
10 – 3
- n2
≈ 2,0
x 10 – 2 mol
|
|
- A ce niveau, il faut faire un tableau
d’avancement de la réaction.
|
|
Équation
|
NaHCO
|
+
CH3COOH
|
→
|
CO2
(g)
|
+
...
|
|
État du
système
|
Avancement
mol
|
1
|
2
|
|
|
|
|
État initial
(mol)
|
x =
0
|
n1
= 3,6
x 10– 2
|
n2
= 2,0
x
10– 2
|
0
|
|
|
Au cours de la
transformation
|
x
|
n1
–
x
|
n2
–
x
|
x
|
|
|
État final
(mol
)
|
x = xmax
|
n1
–
xmax
|
n2
–
x max
|
|
xmax
|
|
|
- Il faut calculer la valeur
de xmax
- Hypothèse 1 :
- On considère que le réactif
limitant est l’hydrogénocarbonate de sodium.
- En fin de réaction, il a été totalement consommé, on
peut écrire :
- n1
–
xmax1
= 0
- n1
–
xmax1
= 3,6
x
10 – 2 mol
- Hypothèse 2 :
- On considère que le réactif
limitant est l’acide éthanoïque.
- En fin de réaction, il a été totalement consommé, on
peut écrire :
- n2
–
xmax2
= 0
- n2
–
xmax2
= 2,0
x
10 – 2 mol
- Conclusion :
- On ne peut pas consommer plus de réactif
qu’il n’y en a.
- L’avancement maximal est égal à la plus petite des deux
valeurs trouvées :
- xmax
=
xmax2
= 2,0
x
10 – 2 mol
< xmax1
= 3,6
x
10 – 2 mol
|
 Quelle est la quantité de matière théorique
ntheo
de gaz ?
Quelle est la quantité de matière théorique
ntheo
de gaz ?
|
-
Quantité de matière théorique de dioxyde de carbone :
-
ntheo
= xmax
=
max2
= 2,0
x
10 – 2 mol
- Volume théorique de gaz :
- Vtheo
= ntheo
. Vm
- Vtheo
≈
2,0
x
10 – 2
x
24
- Vtheo
≈
0,48 L
|
 Calculer la valeur de l’écart relatif
Calculer la valeur de l’écart relatif
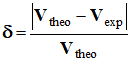 et donner sa valeur en pourcentage.
et donner sa valeur en pourcentage.
|
- Écart relatif :
-
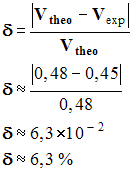
|
|
Commentaires :
- Le résultat est médiocre.
- Quelles sont les explications que l’on peut donner pour
justifier ce résultat ?
|
|
Matériel :
Pour les préparateurs
|
|
Matériel :
|
Élèves : chariot ou paillasse
- Tubes à essais
- spatules
- tube à dégagement
- pipette jaugée de 20 mL
et propipette
- ballon de baudruche
- Entonnoir
- Flacon de 125 mL
- Fil inextensible
- Verre de montre
|
|
Solutions :
|
- Hydrogénocarbonate de
sodium
- Vinaigre à 6 ° (de
concentration C = 1 mol / L
en acide éthanoïque que l’on
note (H+ + A–)
|
|
Matériel :
|
Professeur : bureau
- balance électronique
|