|
|
|
Étude d’une transformationchimique Énoncé. |
|
|
Objectifs : ► Déterminer des quantités de matière en réactif et produit. ► Effectuer une transformation chimique, ► Identifier un gaz, ► Trouver le réactif limitant expérimentalement et par le calcul.
►
Comparer une valeur théorique et une
valeur expérimentale. |
I- Aspect qualitatif.
a)- Mode opératoire.
![]() Dans un tube à essais,
Dans un tube à essais,
- verser 1 mL environ de vinaigre.
- Préparer un autre tube à essais contenant de l’eau de chaux pour la caractérisation du gaz.
- Placer à l’aide d’une spatule de l’hydrogénocarbonate de sodium dans le premier tube à essais.
- Rapidement surmonter l’ensemble d’un tube à dégagement dont l’extrémité est en contact avec
l’eau de chaux contenue dans le deuxième tube à essais
b)- Observation et compte rendu.
![]() Rappeler la formule de l’ion sodium.
Rappeler la formule de l’ion sodium.
![]() L’hydrogénocarbonate de sodium étant un solide ionique.
L’hydrogénocarbonate de sodium étant un solide ionique.
![]() Quelle
est la nature et la valeur de la charge électrique de l’ion hydrogénocarbonate ?
Quelle
est la nature et la valeur de la charge électrique de l’ion hydrogénocarbonate ?
![]() Sachant que ce dernier est formé d’un atome d’hydrogène, d’un
atome de carbone et de trois atomes d’oxygène,
Sachant que ce dernier est formé d’un atome d’hydrogène, d’un
atome de carbone et de trois atomes d’oxygène,
![]() Donner l’écriture chimique du
solide.
Donner l’écriture chimique du
solide.
- Le vinaigre est une solution d’acide éthanoïque de formule CH3COOH
![]() Schématiser la transformation chimique et la mise en évidence
du produit formé.
Schématiser la transformation chimique et la mise en évidence
du produit formé.
![]() Le produit formé peut-il être unique ? Justifier.
Le produit formé peut-il être unique ? Justifier.
![]() Écrire l’équation bilan de la réaction.
Écrire l’équation bilan de la réaction.
II- Aspect quantitatif.
On veut déterminer la quantité du gaz qui se dégage par la mesure de son volume.
a)- Mode opératoire.
![]() Peser à l’aide d’une balance électronique et d’un verre
de montre environ
Peser à l’aide d’une balance électronique et d’un verre
de montre environ
- Noter la valeur exacte de la masse prélevée : m = 3,0 g
- Introduire dans le ballon de baudruche la quantité d’hydrogénocarbonate pesée à l’aide de l’entonnoir.
- Verser dans le flacon 20 mL de vinaigre à 6 °
- Adapter le ballon à l’orifice du flacon puis faire tomber la totalité de la poudre du ballon dans le flacon
(Attention : maintenir le ballon) : observer.
- Agiter prudemment le flacon jusqu’à ce que l’effervescence cesse.
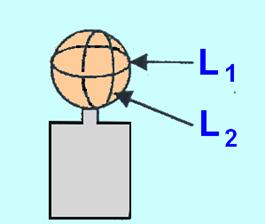
- Mesurer le volume gazeux lorsque la réaction est finie.
- Pour cela, on assimilera le ballon à une sphère et on déterminera le diamètre moyen du ballon à partir de la mesure de la circonférence moyenne du ballon à l’aide d’un fil inextensible :
- On utilisera la relation suivante :
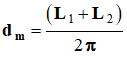 .
.
b)- Compte-rendu.
![]() Déterminer le volume
vexp de
gaz formé (Volume d’une sphère :
Déterminer le volume
vexp de
gaz formé (Volume d’une sphère :
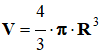 ).
).
![]() Déterminer la quantité de matière
nexp de
gaz formé.
Déterminer la quantité de matière
nexp de
gaz formé.
- On prendra : vm = 24,0 L / mol.
![]() Quel est le réactif limitant lors de l’expérience ?
Justifier par le calcul.
Quel est le réactif limitant lors de l’expérience ?
Justifier par le calcul.
![]() Quelle est la quantité de matière théorique
ntheo
de gaz ?
Quelle est la quantité de matière théorique
ntheo
de gaz ?
![]() Calculer la valeur de l’écart relatif
Calculer la valeur de l’écart relatif
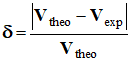 et donner sa valeur en pourcentage.
et donner sa valeur en pourcentage.
|
Matériel :
Pour les préparateurs |
|
Matériel :
|
Élèves : chariot ou paillasse
- Tubes à essais
- spatules
- tube à dégagement
- pipette jaugée de 20 mL
et propipette
- ballon de baudruche
- Entonnoir
- Flacon de 125 mL
- Fil inextensible
- Verre de montre |
|
Solutions :
|
- Hydrogénocarbonate de
sodium
- Vinaigre à 6 ° (de
concentration C = 1 mol / L
en acide éthanoïque que l’on
note (H+ + A–)
|
|
Matériel : |
Professeur : bureau
- balance électronique |