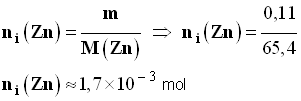|
Chim. N° 03 |
Suivi d’une transformation chimique COURS. |
|
Programme 2011 :
Physique et
Chimie
Programme 2020 :
Physique et
chimie
|
Changement de couleur et réaction chimique (tableau) Changement de couleur et réaction chimique (Questy) |
Pour aller plus loin :
|
Mots clés : transformation chimique ; réaction chimique ; quantité de matière ; avancement de la réaction ; état initial ; état final ; avancement final ; avancement maximal ; mélange stœchiométrique ; ... |
|
|
I-
La
transformation chimique.![]()
1)- Description d’un système chimique.
- Un système chimique est constitué par l’ensemble des espèces chimiques auxquelles on s’intéresse.
- Pour décrire un système chimique, il faut préciser :
- La nature, la quantité de matière et l’état physique (solide, liquide ou gazeux) des différentes espèces chimiques qui constituent le système.
- Les conditions de température T et de pression p.
- Définition :
- Un système subit une transformation chimique si la nature et (ou) la quantité de matière des espèces chimiques sont différentes à l’état initial et à l’état final.
- Exemple : Une solution d’acide chlorhydrique (H + (aq) + Cl − (aq) ) réagit avec le magnésium métal.
-
On
observe un dégagement gazeux de dihydrogène,
H2
|
|
état
initial
(E.I) |
Transformation
chimique |
état
final
(E.F) |
|
Espèces chimiques |
p = 1013 hPa
θ =
|
→ |
p = 1013 hPa
θ =
|
|
H+ (aq) |
ni (H+ ) =
|
nf (H+ )
= ? |
|
|
Mg
|
ni (Mg) = |
nf (Mg) = ? |
|
|
H2 (g) |
ni (H2)
= 0 mol |
nf (H 2) = ? |
|
|
Mg
2+ |
ni (Mg
2+ ) =
0 mol |
nf (Mg2+
) = ? |
|
|
Cl
− (aq)
|
ni (Cl
− ) |
nf (Cl
− ) = ni (Cl
− ) |
|
|
H2O (ℓ) |
Large
excès : Solvant |
Solvant |
- Lors de la réaction, les ions chlorure sont des ions spectateurs, ils ne participent pas à la réaction.
- D’autre part, l’eau est le solvant, il est en large excès. On ne fera pas de calcul sur l’eau.
2)- La réaction chimique et son équation.
- La réaction chimique rend compte, à l’échelle macroscopique de l’évolution d’un système subissant une transformation.
- On représente la réaction chimique par une équation.
- On note à gauche la formule des réactifs et à droite la formule des produits.
- Entre les réactifs et les produits, une flèche indique le sens d’évolution du système.
Réactifs →
Produits
- Exemple : réaction antre l’acide chlorhydrique et le magnésium :
|
Mg
(s)
+
2 H+
(aq) →
Mg2+
(aq) +
H2 |
- Le coefficient placé devant chaque espèce chimique est appelé
; nombre stœchiométrique.
- Il faut ajuster les nombres stœchiométriques afin de respecter la conservation des éléments chimiques et la conservation de la charge électrique.
- Par convention, on n’écrit pas le nombre stœchiométrique 1.
- Les nombres stœchiométriques nous renseignent sur les proportions en quantités de matière.
- Traduction de la réaction précédente :
- 1 mole de magnésium réagit avec 2 moles d’ions hydrogène pour donner 1 mole d’ions magnésium et 1 mole de dihydrogène gazeux.
II-
Évolution
des quantités de matière au cours d’une transformation chimique.![]()
a)- Exemple : la combustion du propane dans le dioxygène donne du dioxyde de carbone et de l’eau.
- On
fait brûler n1
- Les conditions de températures et de pression sont
les suivantes :
p = 1013 hPa et
θ
=
- Formule du propane C3H8
- Donner l’état initial du système chimique.
- Donner l’état final du système chimique obtenu lorsque la réaction est finie.
b)- État initial du système.
|
état
initial
(E.I) |
|
p = 1013 hPa
θ =
|
|
ni (C3H8) = n1 = 1,0 mol |
|
ni (O2) = n2 = 3,0
mol |
|
ni (CO2) =
0,0
mol |
|
ni (H2O) =
0,0 mol |
- Pour donner l’état final du système chimique, il faut utiliser l’équation de la transformation chimique et réaliser un tableau d’avancement de la réaction.
- Équation de la réaction :
|
C3H8
(g)
+
5 O2 (g) →
3 CO2
(g) +
4 H2O (ℓ) |
- Traduction : 1 mole de propane réagit avec 5 moles de dioxygène pour donner 3 moles de dioxyde de carbone et 4 moles d’eau.
c)- Avancement d’une réaction chimique : x (mol).
|
- L’avancement x d’une transformation chimique est une grandeur exprimée en mole qui permet de décrire l’état du système au cours de la transformation. - Il permet d’exprimer les quantités de matière de réactifs et de produits présents dans le système chimique à chaque instant. - L’avancement x est une quantité de matière. - Elle s’exprime en mol. - Dans l’état initial, x = 0, - au cours de la
transformation, 0
≤ x ≤ xmax - À l’état final : x = xmax (ceci au niveau de la classe de seconde). |
d)- Tableau d’avancement de la réaction :
|
Équation |
C3H8 (g) |
+ 5 O2 (g) |
→ |
3
CO2 |
+
4 H2O
(ℓ) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mol) |
x =
0 |
n1
= 1,0 mol |
n2
= 3,0 mol |
0,0 |
0 |
|
|
Au cours
de la
transformation |
x |
1,0
− x |
3,0
– 5 x |
3
x |
4
x |
|
|
État final
(mol) |
x = xmax |
1,0
– xmax
|
3,0
– 5 xmax |
|
3 xmax |
4 xmax |
e)- Réactif limitant et avancement maximal.
- L’avancement maximal xmax s’obtient en écrivant que les quantités de matière des réactifs restent positives ou nulles.
- Il permet de déterminer l’état final de la transformation.
- En général, la réaction s’arrête lorsque l’un des réactifs a été totalement consommé.
- À l’état final, la quantité de matière du réactif limitant est nulle.
- Il se peut que lorsque la réaction s’arrête, tous les réactifs soient entièrement consommés.
- On dit qu’initialement, les réactifs étaient dans les proportions stœchiométriques.
- Comment peut-on déterminer la valeur maximale de x : xmax ?
- En fin de réaction, la quantité de matière de chaque réactif est soit positive, soit nulle.
- En conséquence, on peut écrire deux inéquations :
|
1 –
x
≥
0
|
=> |
1
≥
x
≥
0 |
=> |
|
|
x
≥ 0 |
et |
0,60 ≥
x
≥ 0 |
||
|
3
– 5 x
≥
0
|
3
≥ 5
x
≥ 0
|
|
- En conséquence, l’avancement x peut varier entre 0 et 0,60 mol.
- L’avancement maximal : xmax = 0,60 mol.
- Le réactif limitant est celui qui disparaît totalement c’est-à-dire celui dont la quantité de matière s’annule pour la plus faible valeur de x.
- L’avancement est maximal lorsque le réactif limitant a
totalement disparu : xmax est
la plus petite valeur de
x
pour laquelle la quantité de matière de l’un des réactifs devient nulle.
- Lorsque la valeur de xmax est connue, on peut déterminer les quantités de matière des différentes espèces chimiques dans l’état final du système.
- Il suffit pour cela de rajouter une ligne au tableau.
|
Équation |
C3H8
|
+ 5 O2 (g) |
→ |
3 CO2 (g) |
+ 4 H2O (ℓ) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mol) |
x
= 0 |
n1
= 1 mol |
n2
= 3 mol |
0 |
0 |
|
|
Au cours
de la
transformation |
x |
1,0
– x |
3,0
– 5
x |
3 x |
4 x |
|
|
État final
(mol) |
x = xmax |
1,0
– xmax |
3,0
– 5
xmax |
|
3
xmax |
4
xmax |
|
xmax
= 0,60
mol |
0,40
mol |
0,0
mol |
|
1,8
mol |
2,4
mol |
|
f)- État final du système :
|
état
Final
(E.F) |
|
p = 1013 hPa
θ =
|
|
nf (C3H8)
= 0,40 mol |
|
nf (O2) =
0,0 mol |
|
nf (CO2) =
1,8 mol |
|
nf (H2O)
= 2,4 mol |
2)- Autre méthode pour la détermination de la valeur de xmax.
- On peut déterminer xmax en traçant les droites représentant les variations des quantités de matière des réactifs en fonction de l’avancement x de la réaction.
- Dans le cas précédent :
|
n
(C3H8)
= 1
– x
|
|
|
|
nf (O2)
= 3
– 5
x |
- Les deux droites coupent l’axe horizontal et xmax est égal à la plus petite abscisse des deux points d’intersection.
- Graphe : On peut montrer l’évolution du système grâce à un tableur : ici Excel.
Fichier Excel compressé avec macro (choisir la réaction N° 20)
3)- Cas particulier : Le mélange stœchiométrique.
- Dans certains cas, à la fin de la réaction, tous les réactifs ont été entièrement consommés.
- On dit que dans l’état initial, les réactifs ont été introduits dans les proportions stœchiométriques : le mélange est stœchiométrique.
- Mélange stœchiométrique de propane et de dioxygène : on parle de mélange détonant.
- Graphe :
Fichier Excel compressé avec macro (choisir la réaction N° 20)
- Le bilan de matière d’une transformation chimique donne les quantités de matière des réactifs restants et des produits obtenus à l’état final.
- À partir de ces quantités de matière, on peut calculer des masses, des concentrations, des volumes, des pressions.
1)- Bilan de matière et volume de gaz formé.
|
- Énoncé : Le zinc réagit avec l’acide chlorhydrique pour donner un dégagement gazeux de dihydrogène et des ions Zn2+ (aq) en solution aqueuse. - On fait réagir un volume V1 = 20,0 mL d’acide chlorhydrique de concentration C1 =
5,00 mol / L avec une masse m
= - On précise que les ions chlorure sont des ions spectateurs et que dans les conditions de l’expérience, le volume molaire Vm = 24 ,3 L / mol. - Données : masse molaire du zinc :
M
(Zn) =
- Faire un bilan de matière et calculer le volume V de dihydrogène obtenu dans les conditions de l’expérience. - Comment aborder cet exercice ? |
- Les différentes étapes :
|
1. écrire l’équation de la réaction. 2. Donner l’état initial du système et calculer les quantités de matière des différents réactifs. 3. Dresser un tableau d’avancement de la réaction. 4. Déterminer la valeur de xmax. 5. Faire le bilan de
matière et calculer le volume de dihydrogène obtenu |
- Résolution :
- Équation de la réaction :
|
Zn
(s)
+
2 H+
(aq)
→
Zn2+
(aq) +
H2 |
- État initial et quantité de matière :
|
état
initial (E.I) |
|
Les conditions ne sont pas précisées dans l’énoncé p = ? θ = ? |
|
|
|
ni
(H+
) = C1
.
V1
ni
(H+
) =
5,00
× 20,0
× 10– 3
ni
(H+
) =
0,10 mol |
|
ni (H2) = 0,0 mol |
|
ni (Zn 2+ ) = 0,0 mol |
- Tableau d’avancement de la réaction.
|
Équation |
Zn
|
+ 2 H+ (aq) |
→ |
Zn2+
|
+
H2
|
|
|
État du
système |
Avancement |
mol |
mol |
|
mol |
mol |
|
État initial
(mol) |
x = 0 |
ni
(Zn)
= 1,7 × 10– 3
|
ni
(H+)
= 0,10 |
0 |
0 |
|
|
Au cours
de la
transformation |
x |
1,7
×
10– 3
–
x |
0,10
– 2
x |
x |
x |
|
|
État final
(mol) |
x = xmax |
1,7
×
10– 3
–
xmax |
0,10
– 2
xmax |
|
xmax |
xmax |
|
xmax
= |
|
|
|
|
|
|
- Pour compléter le tableau, il faut déterminer la valeur de xmax.
- On peut calculer les deux valeurs de xmax en résolvant les deux équations suivantes
|
Hypothèse
1 : |
1,7
× 10– 3
–
xmax1
= 0 |
|
HYPOTHèse 2 : |
0,10
– 2 xmax2
= 0 |
- La valeur retenue pour xmax est la plus faible des deux valeurs.
|
1,7
× 10– 3
–
xmax
= 0 |
|
xmax1 =
1,7
× 10– 3
mol
|
|
xmax = xmax1
= 1,7
× 10– 3
mol
|
|
0,10 –
2 xmax
= 0 |
xmax2 = 0,050
mol |
- Maintenant, on peut compléter le tableau et donner l’état final du système.
|
Équation |
Zn
|
+
2 H +
(aq) |
→ |
Zn2+ (aq) |
+ H2 (g) |
|
|
État du
système |
Avancement |
mol |
mol
|
|
mol |
mol |
|
État initial
(mol) |
x =
0 |
ni
(Zn) = 1,7
×
10– 3 |
n
i
(H+) = 0,10 |
0 |
0 |
|
|
Au cours
de la
transformation |
x |
1,7
×
10– 3 –
x |
0,10
– 2 x |
x |
x |
|
|
État final
(mol) |
x = xmax |
1,7
×
10– 3 –
xmax |
0,10
– 2 xmax |
|
xmax |
xmax |
|
xmax =
|
|
|
|
|
|
|
- Le zinc métal est le réactif limitant.
- La réaction s’arrête lorsqu’il est totalement consommé.
- Volume de dihydrogène obtenu en fin de réaction :
|
V
= xmax .
Vm
V
= 1,7
×
10– 3 ×
24 ,3
V ≈ 4,1
×
10– 2
L
V ≈ |
2)- Bilan de matière et pression du gaz formé.
- Énoncé :
- L’acide chlorhydrique réagit avec le carbonate de calcium (CaO3) pour donner du dioxyde de carbone, de l’eau et des ions calcium (Ca2+) en solution aqueuse.
- Les ions chlorure sont des ions spectateurs et l’eau est le solvant.
-
La réaction se fait à température constante. On donne les caractéristiques
de l’état initial du système.
- On donne :
M (C) =
|
|
état
initial
(E.I) |
|
Espèces
chimiques |
p = 1020 hPa
θ =
|
|
H+ |
[ H+]
i =
0,50
mol / L
V =
40 mL |
|
CaCO3
|
mi (CaCO3) =
|
|
Cl
– |
Ions spectateur |
|
H2O |
Large
excès : Solvant |
-
On recueille dans un récipient de volume
V’
=
- Déterminer la valeur de la pression p’ du dioxyde de carbone dans le récipient.
- Équation de la réaction :
|
CaCO3
(s)+
2 H +
(aq) →
Ca2+
(aq) +
CO2
(g)
+
H2O
|
- Quantités de matière :
|
Quantité
de matière de carbonate de calcium :
|
|
Quantité de matière d’ions hydrogène
ni (H+) = C1 .
V1
ni (H+)
= 0,50
×
40,0
× 10– 3
ni (H+)
= 2,0
× 10– 2 mol |
- Tableau d’avancement de la réaction.
|
Équation |
CaCO3 (s) |
+ 2 H+ (aq) |
→ |
Ca2+(aq)
(aq) |
+
CO2
(g)
|
+ H2O (ℓ) |
|
|
État du
système |
Avanc. |
|
|
|
|
|
|
|
État initial
(mol) |
x
= 0 |
8,0
×
10– 3
|
2,0
×
10– 2
|
0 |
0 |
Excès |
|
|
Au cours
de la
Trans. |
x |
8,0
×
10– 3
–
x |
2,0
×
10– 2
–
2
x |
x |
x |
Excès |
|
|
État final
(mol) |
x
=
xmax |
8,0
×
10– 3
–
xmax |
2,0 × 10– 2 – 2 xmax |
|
xmax |
xmax |
Excès |
|
xmax
= |
|
|
|
|
|
Excès |
|
- La valeur retenue pour xmax est la plus faible des deux valeurs.
|
8,0
× 10– 3
–
xmax
= 0 |
=> |
xmax1 = 8,0 × 10– 3 mol |
=> |
xmax = xmax1 = 8,0 × 10– 3 mol |
|
2,0
× 10– 2
– 2
xmax
= 0 |
xmax2
= 1,0
×
10– 2
mol |
- Conclusion le carbonate de calcium est le réactif limitant.
- Les ions hydrogène ont été introduits en excès.
- Tableau final :
|
Équation |
CaCO3 (s) |
+ 2 H+ (aq) |
→ |
Ca2+ |
+
CO2
(g) |
+ H2O (ℓ) |
|
|
État du
système |
Avanc. |
|
|
|
|
|
|
|
État initial
(mol) |
x
= 0 |
8,0
×
10– 3
|
2,0
×
10– 2
|
0 |
0 |
Excès |
|
|
Au cours
de la
Trans. |
x |
8,0
×
10– 3
–
x |
2,0
×
10– 2
–
2
x |
x |
x |
Excès |
|
|
État final
(mol) |
x
=
xmax |
8,0 × 10– 3 – xmax |
2,0
×
10– 2
– 2
xmax |
|
xmax |
xmax |
Excès |
|
xmax
= |
0 |
4,0
×
10– 3
|
|
8,0
×
10– 3
|
8,0
×
10– 3
|
Excès |
|
- Pression du dioxyde de carbone.
- On peut considérer que le dioxyde de carbone se comporte comme un gaz parfait.
- On peut utiliser la relation suivante :
p V
= n R
T
-
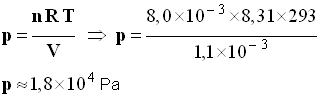
|
Changement de couleur et réaction chimique (tableau) Changement de couleur et réaction chimique (Questy) |
|
|