|
Dosage d'un comprimé de vitamine C Correction |
|
|
|
|
|
|
Vérifier la masse d'acide
ascorbique contenu dans un comprimé d'un produit du commerce et déterminer la valeur du pKA de cet acide. |
1)- Introduction
-
L'acide ascorbique ou vitamine C,
de formule C6H8O6,
peut être considéré comme un monoacide faible.
-
L'acide
ascorbique sera noté : AsbH
-
et sa base conjuguée : l'ion ascorbate
Asb–
2)- Préparation
de la solution SA.
![]() Écraser
soigneusement un comprimé (mortier et pilon).
Écraser
soigneusement un comprimé (mortier et pilon).
-
Avec la poudre obtenue préparer
100 mL d'une
solution SA
d'acide ascorbique.
-
Faire des schémas annotés représentant
les différentes phases de la manipulation.
3)- Écrire
l'équation bilan simplifiée de la réaction chimique. Calculer la masse molaire
de l'acide ascorbique.
III-
DOSAGE DE LA SOLUTION SA.
1)- Étalonnage
du pH-mètre.
2)- Manipulation.
![]() Prélever
un volume VA
= 20 mL de la solution
SA
à l'aide d'une pipette jaugée (20,0 mL).
Prélever
un volume VA
= 20 mL de la solution
SA
à l'aide d'une pipette jaugée (20,0 mL).
-
Verser dans un bécher.
-
Dans la burette graduée, verser la
soude jusqu'au zéro de la graduation.
-
La concentration de la soude
CB
= 5,00
× 10–2 mol.L–1.
3)- Tableau
de mesures.
-
Verser progressivement la solution de
soude SB
dans la solution SA
et suivre l'évolution du pH.
-
On peut utiliser le rouge de crésol
comme indicateur coloré.
0 mL <
VB
< 20 mL
![]() Compléter le tableau
Compléter le tableau
|
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VB
(mL) |
0 |
… |
… |
… |
… |
… |
|
|
… |
… |
… |
… |
… |
… |
… |
20 |
1)- Sachant
que pour l'acide ascorbique :
pKA =
4,1.
-
Écrire l'équation bilan de la réaction
ayant lieu lors du dosage.
-
Cette réaction est-elle quasi-totale ou
limitée.
-
Justifier la réponse en utilisant
l'échelle des pKA.
2)- Tracer
le graphe pH = f (VB)
:
-
Échelles : 1 cm ↔1 mL et 1
cm ↔ 1 unité pH.
-
Observations et remarques.
3)- Déterminer
graphiquement les coordonnées du point d'équivalence
E.
-
Quand dit-on qu'il y a équivalence lors
d'un dosage ?
-
Pourquoi
pHE
est-il supérieur à
7 ?
-
Quelles sont les espèces majoritaires à
l'équivalence ?
-
On peut faire une étude rapide à l'aide
de l'échelle des
pKA.
à
partir de la connaissance de
:
-
Déterminer la concentration
CA
de la solution SA
d'acide ascorbique.
-
En déduire la quantité de matière
nA
contenue dans les 20 mL
de la solution SA.
-
En déduire la quantité de matière
n et la
masse m
d'acide ascorbique contenu dans un comprimé.
4)- Déterminer
la concentration de toutes les espèces présentes à la demi-équivalence.
-
Quel nom donne-t-on à la solution
obtenue à la demi-équivalence ?
-
Quelle est sa propriété ?
-
Montrer que la valeur du
pH de la solution à
la demi-équivalence est égale au
pKA
de l'acide considéré.
-
En déduire une méthode simple
permettant de déterminer le
pKA
d'un acide faible à partir du graphe
pH = f (VB).
1)- L'acide
ascorbique ou vitamine C.
-
L’acide
L–ascorbique se présente sous forme de cristaux blancs, solubles dans l’eau et
l’alcool, insolubles dans les solvants des graisses.
-
La
solution aqueuse est dextrogyre.
-
L’antipode optique ne possède pas d’activité vitaminique ; celle-ci est donc
liée à la structure spatiale.
-
Le
groupement essentiel de la vitamine
C
est la fonction ène-diol avec ses hydrogènes mobiles qui confèrent à la molécule
des propriétés acides (formation de sels sodique, plombique, etc.).
-
Cette
fonction est également impliquée dans le rôle physiologique de cette vitamine.
-
L'acide
ascorbique sera noté
AsbH
et l'ion ascorbate, sa base conjuguée
Asb–.
-
Formule brute :
C6H8O6
-
Nom :
5-(1,2-dihydroxyéthyl)-3,4-dihydroxyfuran-2-one
-
Formule
semi-développée :
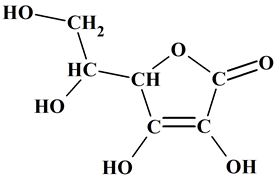
-
Formule topologique :
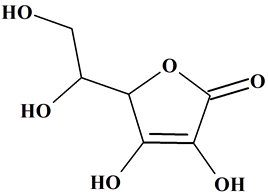
-
On utilise de la vitamine C 500
non tamponnée
(laroscorbine).
-
Il y a 500 mg de
vitamine C par comprimé.
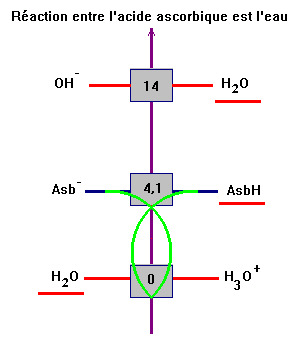
2)- Réaction
de dissolution de l'acide ascorbique dans l'eau.
 Asb–
(aq) + H3O+
(ℓ)
Asb–
(aq) + H3O+
(ℓ)
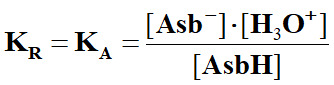
-
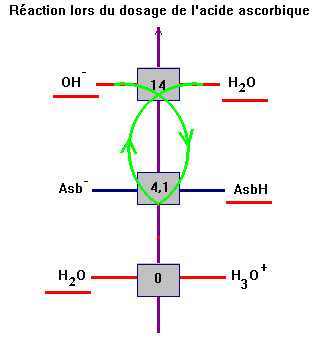
La réaction est limitée
car KR
= KA
= 100 – 4,1 ≈ 7,9 × 10–5.
-
On peut utiliser
l'échelle des pKA
en indiquant les espèces majoritaires.
-
La masse molaire de l'acide ascorbique
est :
-
M (AsbH)
= 176 g . mol–1.
3)- Réaction
de dosage.
-
On réalise le dosage de l'acide
ascorbique par la soude qui est une base forte.
Dans un premier temps, on écrit :
AsbH
(aq) + HO–
(aq)
 Asb–
(aq) + H2O
(ℓ)
Asb–
(aq) + H2O
(ℓ)
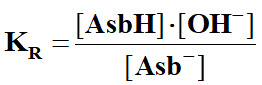
-
Cette réaction est quasi totale :
- KR = 10ΔpKA = 1014 – 4,1
- KR
≈ 7,9 × 109
> 104
-
En conséquence :
AsbH
(aq) + HO–
(aq) → Asb–
(aq) + H2O
(ℓ)
4)- Graphe.
-
Tableau de valeurs :
|
VB
(mL) |
pH |
|
0,0 |
2,8 |
|
1,0 |
3,2 |
|
2,0 |
3,5 |
|
3,0 |
3,7 |
|
4,0 |
3,9 |
|
5,0 |
4,1 |
|
6,0 |
4,2 |
|
7,0 |
4,4 |
|
8,0 |
4,6 |
|
9,0 |
4,8 |
|
9,5 |
4,9 |
|
10,0 |
5,2 |
|
10,2 |
5,3 |
|
10,4 |
5,4 |
|
10,5 |
5,6 |
|
10,6 |
5,7 |
|
10,7 |
5,8 |
|
10,8 |
6,1 |
|
10,9 |
6,6 |
|
11,0 |
8,0 |
|
11,1 |
9,0 |
|
11,2 |
9,4 |
|
11,3 |
9,6 |
|
11,5 |
9,9 |
|
11,7 |
10,1 |
|
12,0 |
10,3 |
|
12,5 |
10,5 |
|
13,0 |
10,7 |
|
14,0 |
10,9 |
|
15,0 |
11,1 |
|
18,0 |
11,4 |
|
20,0 |
11,5 |
-
Le graphe
pH = f (VB)
est une fonction croissante du pH.
-
Au départ le
pH varie
rapidement, puis il varie peu.
-
On observe un saut de
pH et de nouveau le
pH varie
peu.
-
La courbe présente deux points
d'inflexion.
-
Le premier point d'inflexion correspond
à la demi-équivalence et le deuxième à l'équivalence.
-
Coordonnées du point d'équivalence
E :
-
pHE
≈ 7,8 et VBE
≈ 11,0 mL
-
Le
pH est supérieur à 7 à l’équivalence.
|
|
|
|
-
Le pH
> 7 car à l'équivalence, les espèces majoritaires sont l'ion ascorbate
Asb–qui
est une base faible et l'ion Na+
qui est un acide indifférent (acide conjugué d'une base forte : la soude).
5)- Équivalence.
-
Il y a équivalence lorsque les réactifs
ont été mélangés dans les proportions données par les coefficients de la
réaction.
-
À l'équivalence :
-
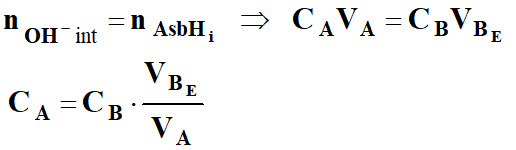
-
Application numérique :
-
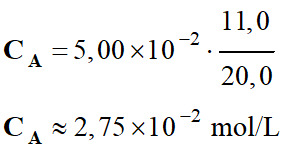
-
Quantité de matière contenue dans les
20 mL de la
solution SA.
-
nA
= CA
. VA
≈ 2,75 × 10–2 × 20,0 × 10–3
-
nA
≈ 5,50 × 10–4 mol
-
Quantité de matière contenue dans un
comprimé (c'est-à-dire dans 100 mL
de solution SA).
-
n
= 5 nA
≈ 5 × 5,50 × 10–4
-
n
= 5 nA
≈ 2,75 × 10–3 mol
-
Masse d'acide ascorbique dans un
comprimé
-
m
= n .
M (AsbH
) ≈ 2,75 × 10–3 × 176
-
m
≈ 484 mg
-
Remarque : le comprimé
utilisé contient m0
= 500 mg d'acide ascorbique.
-
On peut déterminer l'incertitude relative :
-
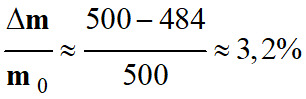
6)- Demi-équivalence.
-
À la demi-équivalence, on a versé
![]() moles
d'ions HO–.
moles
d'ions HO–.
-
Au départ, on a
n moles d'acide
ascorbique.
|
|
|
|
-
En conséquence, après réaction les
quantités de matière d'ion ascorbate et d'acide ascorbique sont les mêmes et de
ce fait les concentrations sont égales :
-
[AsbH]
= [Asb–]
or
-
À l'équivalence, la solution obtenue
est une solution tampon dont le ![]()
-
Une méthode simple de
détermination du pKA
à partir de la courbe pH = f (VB).
-
On détermine les coordonnées du point
d'équivalence E
et à partir de la connaissance de VBE,
on détermine la valeur du pH
de la solution pour :
![]() .
.
|
|