|
TP Chimie N° 04 |
Détermination expérimentale du quotient de réaction. Correction |
|
|
|
|
Programme 2012 : Programme 2020 : |
|
Objectifs : Détermination par conductimétrie du quotient de réaction de l’acide formique (méthanoïque) sur l’eau à différentes concentrations. |
1)- Préparation des trois solutions d’acide formique à partir de la solution mère S de concentrations C = 0,10 mol / L.
![]() Préparer 100,0 mL des trois solutions suivantes, à partir de
la solution mère :
Préparer 100,0 mL des trois solutions suivantes, à partir de
la solution mère :
- S1 de concentration C 1 = 1,0 x 10 – 2 mol / L.
|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié. |
|
On ne pipette jamais directement dans le flacon qui contient
la solution
Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
- S2 de concentration C2 = 2,5 x 10 – 2 mol / L.
- On remplace la pipette jaugée de 10 mL par une fiole jaugée de 25 mL
- S3 de concentration C3 = 5,0 x 10 – 2 mol / L.
- On remplace la pipette jaugée de 10 mL par une fiole jaugée de 50 mL
2)- Mesure de la conductance G de la solution étalon.
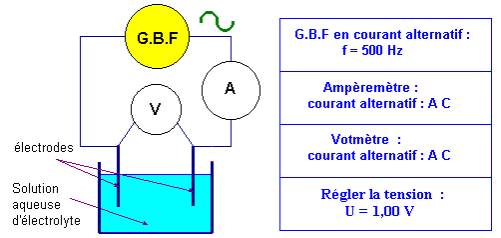
![]() Schématiser et effectuer le montage du conductimètre :
Schématiser et effectuer le montage du conductimètre :
![]() Verser environ 80 mL de la solution étalon
S0 d’acide chlorhydrique
de concentration C0
= 1,0 x 10 – 2
mol / L dans un bécher.
Verser environ 80 mL de la solution étalon
S0 d’acide chlorhydrique
de concentration C0
= 1,0 x 10 – 2
mol / L dans un bécher.
- Régler le G.B.F. sur courant alternatif sinusoïdal, fréquence f = 500 Hz et la valeur de la tension sur U = 1,00 V.
- Plonger la cellule conductimétrique dans la solution. Faire les réglages nécessaires et attendre que le système soit stable. Effectuer la mesure.
3)- Mesure de la conductance des trois solutions.
![]() Pour rincer la cellule, la tremper dans un bécher annexe
contenant un peu de solution S3.
Pour rincer la cellule, la tremper dans un bécher annexe
contenant un peu de solution S3.
- Plonger ensuite la cellule dans un autre bécher contenant la solution S3 et procéder comme pour la solution étalon.
![]() Recommencer ces opérations avec les solutions
S2
et S1.
Recommencer ces opérations avec les solutions
S2
et S1.
4)- Mesures : présenter les différentes mesures sous forme de tableau.
II- Exploitation
des résultats.
1)- Étude de la solution étalon.
![]() Écrire
l’équation de la réaction entre le chlorure d’hydrogène et l’eau.
Écrire
l’équation de la réaction entre le chlorure d’hydrogène et l’eau.
HCl (g) + H2O (ℓ) → Cl – (aq) + H3O +(aq)
- Donner la relation liant la conductance G0, la conductivité de la solution σ0 et les caractéristiques de la cellule.
-
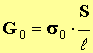 (1)
(1)
- Exprimer σ0 en fonction des conductivités molaires ioniques et des concentrations des ions qu’elle contient.
- σ1 = λ (H3O +) . [ H3O + ] eq + λ (Cl –) . [ Cl – ] eq
- Sachant que la réaction entre le chlorure d’hydrogène et l’eau est totale, simplifier cette expression. On note :
- k0 = (λ (H3O +) + λ (Cl –)) => k0 ≈ 42,61 x 10 – 3 S. m 2 .mol – 1
- Remplacer σ0 par l’expression trouvée précédemment dans celle de la conductance :
- La réaction entre le chlorure d’hydrogène et l’eau étant totale :
-
C0
= [
Cl
–
] = [ H 3
O +
]
- σ0 = (λ (H3O +) + λ (Cl –)) . [ H 3 O + ] eq => σ0 = k0 . C0 (2)
-
Montrer que :
 (a).
(a).
- En combinant (1) et (2), on trouve la relation (a) :
-
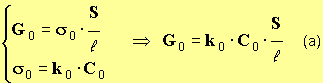
2)- Étude de la solution S 1 d’acide formique.
![]() Écrire
l’équation de la réaction entre l’acide formique (HCOOH)
et l’eau.
Écrire
l’équation de la réaction entre l’acide formique (HCOOH)
et l’eau.
HCOOH (aq) + H2O (ℓ) = HCOO – (aq) + H3O + (aq)
- Donner la relation liant la conductance G1, la conductivité de la solution σ1 et les caractéristiques de la cellule.
-
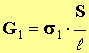 (1)
(1)
- Exprimer σ 1 en fonction des conductivités molaires ioniques et des concentrations des ions qu’elle contient.
- σ1 = λ (H 3 O +) . [ H 3 O + ] eq + λ (HCOO –) . [ HCOO – ] eq
- Simplifier cette expression en exprimant les concentrations en ions oxonium et en ions méthanoate en fonction du taux d’avancement de la réaction et de la concentration C1 de la solution.
- On note :
- k 1 = (λ (H3O +) + λ (HCOO -)) => k 1 ≈ 40,44 x 10 – 3 S. m 2 .mol – 1
-
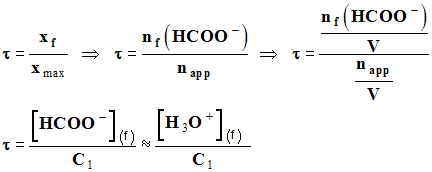
- Remplacer σ1 par l’expression trouvée précédemment dans celle de la conductance
- σ1 = (λ (H3O +) + λ (HCOO –)) . [ H3O + ] eq => σ 1 = k 1 . τ . C 1 (2)
-
Montrer que
 (b)
(b)
- En combinant (1) et (2), on trouve la relation (b) :
-

3)- Taux d’avancement de la réaction entre l’acide formique et l’eau.
![]() Déterminer
l’expression du rapport :
Déterminer
l’expression du rapport :
![]()
- Donner la relation permettant de calculer le taux d’avancement τ de la réaction. Montrer que :
-
 .
.
- À partir des relations (a) et (b), on peut écrire :
-
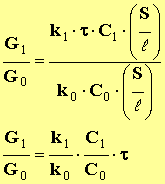
- On en déduit l’expression du taux d’avancement : τ
-
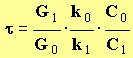
4)- Calcul du taux d’avancement de la réaction.
![]() Calculer
le taux d’avancement de la réaction entre l’acide formique et l’eau
pour les solutions S
1,
S
2 et
S
3.
Calculer
le taux d’avancement de la réaction entre l’acide formique et l’eau
pour les solutions S
1,
S
2 et
S
3.
- Présenter les résultats sous forme de tableau. Comparer et conclure.
|
Solution |
S1 |
S2 |
S3 |
S0 |
|
Concentrations mol / L |
1,0 × 10–2 |
2,5 × 10–2 |
5,0 × 10–2 |
1,0 × 10–1 |
|
Conductance G mS |
1,51 |
2,38 |
3,38 |
13,1 |
|
τ |
12,1 |
7,6 |
5,4 |
référence |
|
Correction |
|
|
|
|
- Le taux d'avancement τ de la réaction dépend de la concentration en acide méthanoïque.
- Lorsque la concentration de la solution en acide éthanoïque augmente, le taux d'avancement τ de la réaction diminue.
5)- Quotient de la réaction entre l’acide formique et l’eau.
![]() Donner
l’expression du quotient de réaction.
Donner
l’expression du quotient de réaction.
- Donner l’expression du quotient de réaction à l’équilibre.
- Exprimer Q r,eq en fonction de τ et de la concentration de l’acide. Montrer que :
-
 pour la solution S1.
pour la solution S1.
- Calculer Q r,eq pour les solutions S1, S2 et S3. Présenter les résultats sous forme de tableau. Comparer et conclure.
- Expression du quotient de réaction Q r et du quotient de réaction à l’équilibre Q r,eq.
- Tableau d’avancement de la réaction :
HCOOH (aq) + H2O (ℓ) = HCOO – (aq) + H3O + (aq)
|
Équation |
HCOOH (aq) |
+ H2O (ℓ) |
= |
HCOO – (aq) |
+ H3O + (aq) |
|
|
état |
Avancement
x
(mmol) |
mmol |
mmol |
|
mmol |
mmol |
|
État
initial (mol) |
0 |
napp |
excès |
|
0 |
0 |
|
Au
cours de la
transformation |
x |
napp - x |
excès |
x |
x |
|
|
Avancement
final |
xf |
napp
–
xf |
excès |
xf |
xf |
|
|
Avancement
maximal |
xmax |
napp
–
xmax
|
excès |
|
xmax |
xmax |
- Concentration molaire des ions présents à l’équilibre :
- D’après l’équation de la réaction :[ H3O + ] eq ≈ [ HCOO – ] eq,
- Car on néglige l’apport des ions oxonium dû à l’eau.
- [ HCOOH ] eq + [ HCOO – ] eq = C1
- Car il n’y a pas de variation de volume.
- [ HCOOH ] eq = C1 – [ HCOO – ] eq
- Taux d’avancement final de la réaction :
-
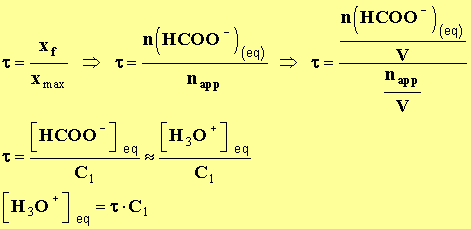
- D’autre part :
- [ HCOO – ] eq = [ H3O+ ] eq = τ . C1
- [ HCOOH] eq + [ HCOO – ] eq = C1 => [ HCOOH ] eq = C1 – [ HCOO - ] eq
- [ HCOOH ] eq = C1 - τ . C1
- [ HCOOH ] eq = C1 . (1 – τ )
- On tire l’expression suivante :
-
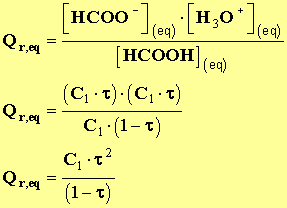
- Calculer Q r,eq pour les solutions S1, S2 et S3. Présenter les résultats sous forme de tableau. Comparer et conclure.
|
Solutions |
S1 |
S2 |
S3 |
S0 |
|
Concentrations
mol / L |
1,0
x
10 –2 |
2,5
x 10 –2 |
5,0
x 10 –2 |
1,0
x 10 –1 |
|
Conductance
G mS |
1,51 |
2,38 |
3,38 |
13,1 |
|
τ % |
12,1 |
7,6 |
5,4 |
référence |
|
Q
r,eq |
1,7
x
10
–4 |
1,6
x
10
–4 |
1,6
x
10
–4 |
|
Q r,eq ≈ cte. Aux erreurs de mesures près, on a montré l’invariance de Q r,eq pour un acide donné. On écrit que : Q r,eq = K (constante l’équilibre) |