|
Chim. N° 09 |
Électrolyse : Exercices. |
|
|
|
|
Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
Pour aller plus loin :
|
Mots clés : Electrolyse, transformation forcée, anode, cathode, oxydation, réduction,... |
I- Applications.
|
Le bilan de l’électrolyse d’une solution aqueuse de chlorure d'étain II, ou chlorure stanneux, s’écrit à l’aide de l’équation suivante :
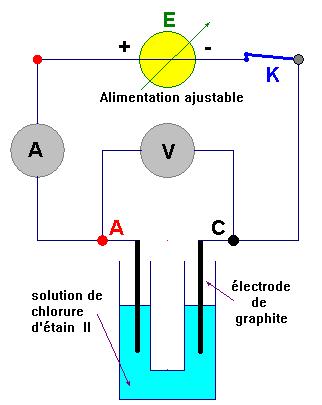
a)- Faire un schéma annoté du montage électrique. b)- Écrire l’équation de la réaction chimique qui a lieu : |
Le
bilan de l’électrolyse d’une solution aqueuse de chlorure d ‘étain II,
ou chlorure stanneux, s’écrit à l’aide de l’équation suivante :
Sn2+(aq)
+ 2
Cl
–
(aq)
=
Sn
(s)
+ Cl2
(g)
a)- Faire un schéma annoté du montage électrique. - Schéma du dispositif :
b)- Écrire l’équation de la réaction chimique qui a lieu : - À l’anode ; - À l’anode se produit une oxydation. -
C’est l’électrode reliée
à la borne positive du générateur. - 2
Cl –
(aq)
= 2
e
–
+ Cl2
(g)
- À la cathode. - À La cathode se produit une réduction. -
C’est l’électrode reliée
à la borne négative du générateur. - Sn 2+(aq)
+ 2
e
–
= Sn
(s)
|
On réalise l’électrolyse d’une solution aqueuse de sulfate de cuivre II entre deux électrodes de graphite inattaquables. Il se produit un dépôt métallique sur l’une des électrodes et un dégagement gazeux sur l’autre. a)- Déterminer la nature du dépôt métallique. Sur quelle électrode se forme-t-il ?- écrire l’équation de la réaction correspondante à la formation du dépôt. b)- Quel type de réaction a lieu sur l’autre électrode ? - Quelle espèce chimique présente en solution est susceptible de subir une telle réaction ? - écrire l’équation de cette réaction et identifier le gaz qui se dégage.
c)- Écrire l’équation globale de la réaction ayant lieu lors de l’électrolyse.
|
|
On réalise l’électrolyse d’une solution aqueuse de sulfate de cuivre II entre deux électrodes de graphite inattaquables. Il se produit un dépôt métallique sur l’une des électrodes et un dégagement gazeux sur l’autre. a)- Déterminer la nature du dépôt métallique. Sur quelle électrode se forme-t-il ?- écrire l’équation de la réaction correspondante à la formation du dépôt. - La nature du dépôt : il se dépose du cuivre métal sur l’électrode. - Il provient de la réduction des ions cuivre II présents dans la solution. - Il
s’agit d’une réduction. L’électrode est la cathode. - Cu2+(aq) + 2 e – = Cu (s) b)- Quel type de réaction a lieu sur l’autre électrode ? - Quelle espèce chimique présente en solution est susceptible de subir une telle réaction ? - écrire l’équation de cette réaction et identifier le gaz qui se dégage. - L’autre électrode, est l’anode et il se produit une oxydation. - Les électrodes étant inattaquables, l’espèce chimique susceptible de subir une oxydation est l’eau. - L’eau
joue le rôle de réducteur : elle est oxydée. - 2 H2O (ℓ) = O2 (g) + 4 H+ (aq) + 4 e – - Il se produit un dégagement de dioxygène à l’anode. c)- Écrire l’équation globale de la réaction ayant lieu lors de l’électrolyse. - Équation de la réaction :
|
Une
solution concentrée de chlorure de sodium, appelée saumure, est électrolysée
entre une anode en titane et une cathode en acier. Les
deux compartiments de l’électrolyse sont séparés par une membrane et les deux
gaz sont recueillis séparément. Les
électrodes ne participent pas chimiquement à l’électrolyse. a)- - À
la cathode, on recueille un autre gaz et de la soude. - Écrire
l’équation de la réaction correspondante. - Écrire
l’équation de la réaction globale qui a lieu lors de cette électrolyse. b)- Une usine produit quotidiennement et en continu - Quelle masse de gaz formé à la cathode et de soude produit-elle
par jour ? - Quelles masses de chlorure de sodium et d’eau sont consommés quotidiennement ? - Quelle est l’intensité du courant électrique utilisé pour réaliser
cette électrolyse ?
|
Une solution concentrée de chlorure de sodium, appelée saumure, est électrolysée entre une anode en titane et une cathode en acier. Les deux compartiments de l’électrolyse sont séparés par une membrane et les deux gaz sont recueillis séparément. Les électrodes ne participent pas chimiquement à l’électrolyse. a)- Quel gaz recueille-t-on à l’anode ? écrire l’équation de la réaction.- À la cathode, on recueille un autre gaz et de la soude. - Écrire l’équation de la réaction correspondante. - Écrire l’équation de la réaction globale qui a lieu lors de cette électrolyse. - Gaz recueilli à l’anode : à l’anode, il se produit l’oxydation des ions chlorure qui donne un dégagement de dichlore : - C’est l’électrode reliée à la borne positive du générateur. - 2 Cl– (aq) = 2 e– + Cl 2 (g)- à la
cathode, il se produit la réduction des molécules d’eau : - 2 H2O (ℓ) + 2 e – = H2 (g) + 2 HO – (aq) - Comme on étudie la solution de soude, (Na+
(aq)
+
HO–
(aq)),
on peut écrire la réaction suivante :
- Réaction globale de l’électrolyse :
b)- Une usine produit quotidiennement et en continu 1,3 tonne du gaz qui se forme à l’anode de l’électrolyse de la saumure. - Quelle masse de gaz formé à la cathode et de soude produit-elle par jour ? - Quelles masses de chlorure de sodium et d’eau sont consommés quotidiennement ? - Quelle est l’intensité du courant électrique utilisé pour réaliser cette électrolyse ? - Tableau d’avancement de la réaction : |
|
|
2
H2O
(ℓ) |
+ 2
(Na+(aq)
+ Cl-(aq)) |
= |
H2
(g) |
+
Cl2 (g) |
+
2
(Na+(aq) + HO–(aq)) |
|
E.I
mol |
n1 |
n2 |
|
0 |
0 |
0 |
|
E F
mol |
n1
– 2
x |
n2
– 2
x |
|
x |
x |
2 x |
|
- Masse de gaz formé à la cathode. - D’après le bilan de quantité de matière de la réaction :
- - Masse de soude obtenue. -
D’après le bilan de quantité de matière, - - Masse de chlorure de sodium consommé. - - Masse d’eau consommée. - - Intensité du courant.
- |
4)- Exercice 24 page 227. électrolyse d’une solution de chlorure de cuivre II.
Une
solution de chlorure de cuivre II est électrolysée avec des électrodes de
graphite. a)- - Décrire les observations expérimentales qui confirmeraient
ces
prévisions. b)- En réalité, on observe un dégagement de dichlore et de
dioxygène au cours
de l’électrolyse. - À quelle(s) électrode(s) ces dégagements ont-ils lieu ?
- Écrire l’équation de la réaction complétant celles écrites à la
question a)-. - Comment peut-on mettre en évidence le dégagement de
dioxygène ? c)- - Donner l’équation de la réaction globale qui a lieu lors de
l’électrolyse. - Vérifier que lors de cette réaction, l’égalité suivante est bien
vérifiée : d)- - Quelle est la quantité de matière d’électrons échangés
n
(e
–)
éch
pendant cette durée ? - En déduire l’avancement final
xf de la réaction à la fin de
l’électrolyse. - Quel volume de gaz
V a-t-on recueilli
dans les conditions expérimentales où le volume molaire
Vm = 24 L / mol. - Quelle masse maximale de solide peut-on espérer obtenir ? e)-
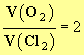 .
.
|
Une solution de chlorure de cuivre II est électrolysée avec des électrodes de graphite. a)- Quelles réactions mettant en jeu les ions chlorure et les ions cuivre II peut-on s’attendre à observer aux deux électrodes ?- Décrire les observations expérimentales qui confirmeraient ces prévisions. - Réactions susceptibles de se produire aux électrodes : - À l’anode, on peut observer l’oxydation des ions chlorure qui donne un dégagement de dichlore : - C’est l’électrode reliée à la borne positive du générateur. - On peut observer une coloration verdâtre à l’anode. -
Ce gaz décolore l’indigo. - 2
Cl
–
(aq)
= 2
e
–
+ Cl2
(g)
- à la cathode, on peut observer la réduction des ions cuivre II en cuivre métal. -
On peut observer la formation d’un dépôt rougeâtre. - Cu2+(aq) + 2 e – = Cu (s) b)- En réalité, on observe un dégagement de dichlore et de dioxygène au cours de l’électrolyse. - À quelle(s) électrode(s) ces dégagements ont-ils lieu ? - Écrire l’équation de la réaction complétant celles écrites à la question a)-. - Comment peut-on mettre en évidence le dégagement de dioxygène ? - Les dégagements gazeux de dioxygène et de dichlore ont lieu à l’anode. - Le dioxygène provient de l’oxydation des molécules d’eau. - 2
Cl
–
(aq)
= 2
e
–
+ Cl2
(g)
- et : - 2 H2O (ℓ) = O2 (g) + 4 H+ (aq) + 4 e– - Le dioxygène est un gaz qui ravive la combustion d’une
bûchette présentant
un point incandescent. c)- Lors de l’électrolyse, le rapport des volumes de dioxygène
V
(O2) et de dichlore V (Cl2) recueillis est égal à :
- Donner l’équation de la réaction globale qui a lieu lors de l’électrolyse. - Vérifier que lors de cette réaction, l’égalité suivante est bien vérifiée : - n (e –) éch = 10 x où x est l’avancement de la réaction. - Équation globale de la réaction d’électrolyse. - Réaction 1 :
- Réaction 2 :
- La réaction globale est une combinaison de ces deux réactions qui se
produisent simultanément. - Comme :
4 H2O(ℓ) + 2 Cl –(aq) + 5 Cu2+(aq) = 5 Cu (s) + 2 O2 (g) + 8 H +(aq) + Cl2 (g) |
Tableau d’avancement de la réaction :
|
|
4
H2O(ℓ) |
+
2 Cl–(aq) |
+
5 Cu2+(aq) |
= |
5
Cu (s) |
+
2
O2
(g) |
+
8
H+(aq) |
+
Cl2
(g) |
|
E.I
mol |
n1 |
n2 |
n3 |
|
0 |
0 |
0 |
0 |
|
E.F
mol |
n1
– 4
x |
n2
– 2
x |
n3
– 5
x |
|
5 x |
2 x |
8 x |
x |
|
- Relation donnant la quantité de matière d’électrons échangés.
- On en déduit la relation :
n
(e
–)
éch
= 10 x. d)- L’électrolyseur est traversé pendant 9650 s par un courant électrique d’intensité égale à 2,0 A. - Quelle est la quantité de matière d’électrons échangés n (e –) éch pendant cette durée ? - En déduire l’avancement final xf de la réaction à la fin de l’électrolyse. - Quel volume de gaz V a-t-on recueilli dans les conditions expérimentales où le volume molaire Vm = 24 L / mol. - Quelle masse maximale de solide peut-on espérer obtenir ? - Quantité de matière d’électrons échangés :
- Avancement final de la réaction :
- Volume de gaz : - V = V (O2) + V (Cl2) = 2 xf . Vm + xf . Vm = 3 xf . Vm - V = 3 x 2,0 x 10 – 2 x 24 - V ≈ 1,4 L - Masse maximale de solide : - m (Cu) = n (Cu) . M (Cu) = 5 xf x M (Cu) - m (Cu) = 5 x 2,0 x 10 – 2 x 63,5 - m (Cu) ≈ 6,4 g e)- Le bilan de l’électrolyse est-il modifié lorsque l’on utilise des électrodes de cuivre à la place des électrodes de graphite ? - Le bilan de l’électrolyse est modifié car l’anode intervient dans l’électrolyse. - On effectue une électrolyse avec anode soluble. - Tout se passe comme si le cuivre était transféré de l’anode vers la cathode. - Il se produit l’oxydation du cuivre à l’anode. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||