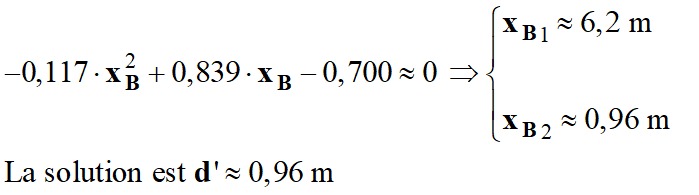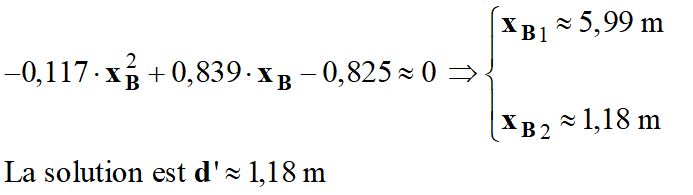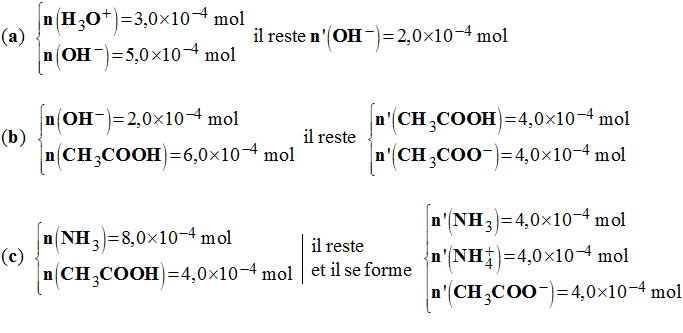|
Contrôle N° 03 Sciences physiques 2000
Terminale S énoncé et correction |
|
|
|

On étudie la trajectoire du centre d’inertie d’un ballon de basket-ball lancé par un joueur.
On ne teindra pas compte ni de la résistance de l’air, ni de la rotation éventuelle du ballon sur lui-même.
Le lancer est effectué vers le haut ; on lâche le ballon lorsque son centre d’inertie est en A (voir schéma).
Sa vitesse initiale est représentée par le vecteur
 situé dans le
plan vertical
situé dans le
plan vertical
 et faisant un angle α avec
l’axe horizontal.
et faisant un angle α avec
l’axe horizontal.
1)- Établir les équations horaires du mouvement du centre d’inertie du ballon. En déduire l’équation de la trajectoire.
-
équations
horaires du mouvement du centre d’inertie du ballon.
-
Système : le ballon ; le référentiel : Terrestre supposé Galiléen ;
Conditions initiales :
-
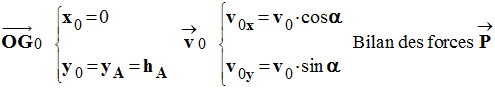
-
Théorème du centre d’inertie :
-
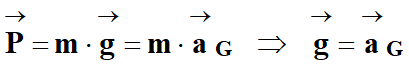
-
Par intégrations successives, on trouve :
-
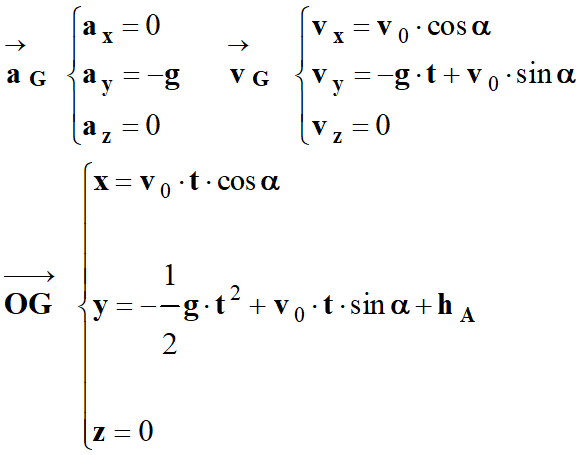
-
équation
de la trajectoire : on élimine le temps entre
x et
y
-
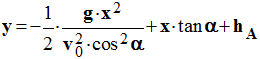
2)- Calculer la vitesse initiale du ballon, pour que celui-ci (le centre d’inertie du ballon) passe exactement par le point C, centre du panier.
- Vitesse initiale du ballon
- Le centre d’inertie du ballon doit passer par le point C :
-

-
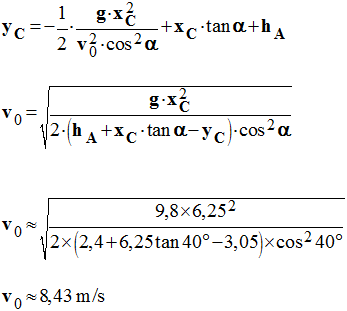
3)- Un défenseur BD, placé entre l’attaquant et le panneau de basket saute verticalement pour intercepter le ballon :
L’extrémité de sa main se trouve en B à l’altitude hB = 3,10 m.
à quelle distance horizontale maximale d’ de l’attaquant doit-il se trouver pour toucher le ballon du bout des doigts ?
- Données : g = 9,8 m / s2 ; α = 40 °; diamètre du ballon : 25 cm ;
-
hA =
2,40 m ; hB = 3,10 m ;
hC = 3,05 m ;
d = 6,25 m
- distance horizontale maximale d’ pour toucher le ballon du bout des doigts.
- Les doigts doivent se trouver au point B de coordonnées :
-
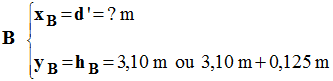
- En reprenant l’équation :
-
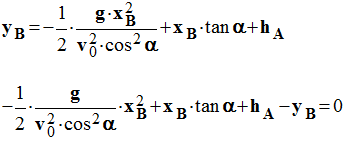
- Il faut résoudre une équation du type :
-
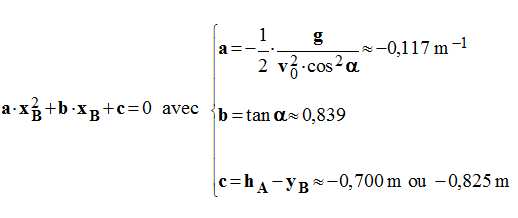
- Ou :
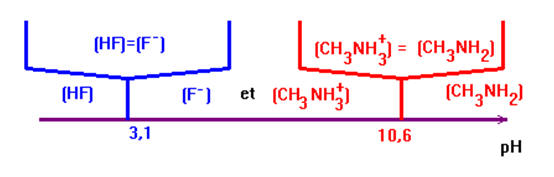
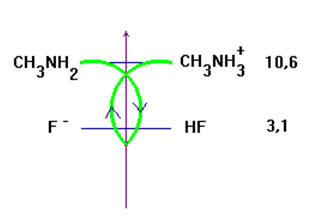
1)- Tracer les domaines de prédominance relatifs des couples HF / F– ; pKA1 = 3,2 et CH3NH3+ / CH3NH2 ; pKA2 = 10,6.
- Domaines de prédominances :
2)- On mélange 50 mL de solution d’acide fluorhydrique de concentration C = 1,0 × 10 – 1 mol / L et 50 mL de solution de méthanamine de concentration C’ = 1,0 × 10 – 1 mol / L.
a)- Quelle est la réaction qui a lieu ? Calculer sa constante KR. Conclure.
- réaction et constante KR. conclusion.
-
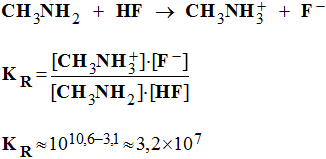
- La réaction est quasi totale.
b)- Quelles sont les espèces prédominantes en fin de réaction ? calculer leurs concentrations.
- Espèces prédominantes et concentrations :
-
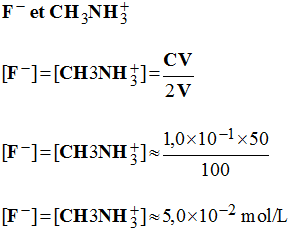
III- Il ne faut pas faire de mélange.
On mélange les solutions suivantes :
|
25 mL
de solution d’acide chlorhydrique de concentration |
C1
= 1,0 × 10–1 mol / L |
|
25 mL
de solution de soude de concentration |
C2
= 2,0 × 10–2 mol / L |
|
25 mL
de solution d’acide éthanoïque de concentration |
C3
= 2,4 × 10–2 mol / L et de pKA
= 4,8 |
|
25 mL
de solution aqueuse d’ammoniac de concentration |
C4
= 3,2 × 10 – 2 mol / L et de pKA
= 9,2 |
1)- Indiquer les réactions prépondérantes successives. Les qualifier.
- Réaction prépondérantes successives :
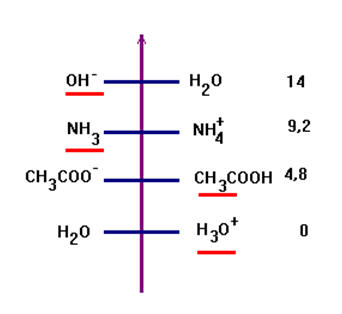
(a) HO– + H3O+ → 2 H2O
(b) HO– + CH3COOH → CH3COO– + H2O
(c) NH3 + CH3COOH → CH3COO– + NH4+
- Les qualifier : Les réactions sont quasi totales.
2)- Quel est le couple acido-basique dont les deux espèces sont majoritaires ? Justifier.
- couple acido-basique dont les deux espèces sont majoritaires.
-
En fin de réaction :
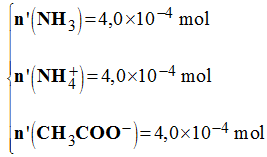
3)- En déduire la valeur du pH de la solution. Justifier.
- valeur du pH de la solution.
- Le pH dépend du couple :
- NH4+ / NH3 : comme : [NH4+] =[ NH3] => pH ≈ pKA ≈ 9,2