|
Contrôle N° 04 Sciences physiques Classe de seconde énoncé et correction |
|
|
|
I- Équations bilans.
équilibrer les réactions suivantes :
H2O
+ Al → Al2O3
+ H2
Fe3O4
+ CO → FeO
+ CO2
NO2
+ H2O →
HNO3 + NO
Fe
+ H2O →
Fe3O4 +
H2
Al
+ MnO2 → Al2O3
+ Mn
3
H2O +
2 Al →
Al2O3 +
3 H2
Fe3O4
+ CO →
3 FeO +
CO2
3
NO2 + H2O
→ 2 HNO3
+ NO
3
Fe + 4
H2O → Fe3O4
+ 4 H2
4
Al + 3
MnO2 → 2
Al2O3 +
3 Mn
II- Réaction chimique.
On veut faire brûler m1 = 4,0 g de sodium Na dans du dioxygène gazeux O2.
Il se forme de l'oxyde de sodium de formule : Na2O.
équation bilan de la réaction :
4 Na +
O2 → 2 Na2O
1)- Calculer la quantité de matière de dioxygène nécessaire à la combustion complète de tout le sodium.
- Quantité de matière de dioxygène nécessaire à la combustion complète de tout le sodium :
- Dans un premier temps, il faut calculer la quantité de matière de sodium :
- Quantité de matière n1 de sodium
-


- Tableau d’avancement :
- On note n2 la quantité de matière de dioxygène nécessaire.
- En fin de réaction, tout le sodium et tout le dioxygène ont été consommés.
|
|
4 Na |
+ |
O2 |
→ |
2 Na2O |
|
État initial |
n1 ≈ 0,17 mol |
|
n2 ≈ ? |
|
0 |
|
État Intermédiaire |
n1 – 4 x |
|
n2 – x |
|
2 x |
|
État final |
n1 – 4
xmax = 0 |
|
n2 –
xmax = 0 |
|
2 xmax |
-
En conséquence :

- Quantité de matière n2 de dioxygène nécessaire :
-


2)- En déduire la masse m2 et le volume V de dioxygène nécessaire.
- Masse de dioxygène nécessaire :
-
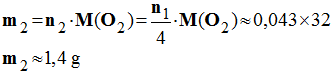
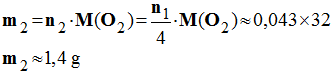
- Volume de dioxygène nécessaire :
-
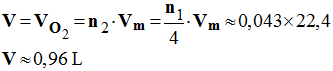
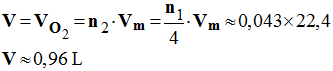
3)- En déduire la masse m' de produit obtenu.
- Masse de produit obtenu :
-


On fait brûler une masse m1 = 4,0 g de sodium dans un volume V2 = 2,0 L de dioxygène.
4)- La réaction s'arrête par manque d'un des réactifs. Lequel ? Justifier.
- Réactif en excès :
- Pour connaître le réactif en excès, il faut dans un premier temps les quantités de matière de chaque réactif :
- Quantité de matière n1 de sodium (voir question 1)-)
-


- Quantité de matière de dioxygène :
-
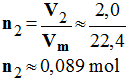
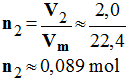
|
|
4 Na |
+ |
O2 |
→ |
2 Na2O |
|
État initial |
n1 ≈ 0,17 mol |
|
n2
≈ 0,089 mol |
|
0 |
|
État Intermédiaire |
n1 – 4 x |
|
n2 – x |
|
2 x |
|
État final |
|
|
|
|
|
- Il faut calculer la valeur de l’avancement maximal de la réaction :
-
Détermination de xmax.
- Hypothèse 1 : on considère que le réactif limitant est le sodium :
-

- Hypothèse 2 : on considère que le réactif limitant est le dioxygène :
-
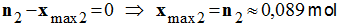
- L’avancement maximal est égal à la plus petite des deux valeurs :
- xmax = xmax1 ≈ 0,043 mol
- Le réactif limitant est le sodium.
- le dioxygène est en excès, le sodium limite la réaction.
- Il faut raisonner par rapport au sodium Na.
- Bilan de la réaction :
|
|
4 Na |
+ |
O2 |
→ |
2 Na2O |
|
État initial |
n1 ≈ 0,17 mol |
|
n2
≈ 0,089 mol |
|
0 |
|
État Intermédiaire |
n1 – 4 x |
|
n2 –
x |
|
2 x |
|
État final |
n1 – 4 xmax1 = 0 |
|
n2 –
xmax1 |
|
2 xmax1 |
|
État final (mol) |
0 |
|
0,089 – 0,043 ≈ 0,046 |
|
2 x 0,043 ≈ 0,086 |
- Remarque : on peut utiliser le résultat de la question 1)- .
- Comme le volume de dioxygène utilisé pour la question 4)- est supérieur à 0,96 L, on peut affirmer que le dioxygène est en excès.
5)- Calculer la masse m3 du produit formé.
- Masse de produit formé, c'est la même que celle de la question 3)-.
- m3 ≈ 0,086 × (2 × 23 + 16)
- m3 ≈ 5,3 g
6)- Calculer la masse restante m4 du réactif en excès.
- Masse restante du réactif en excès.
- m4 ≈ 0,046 × (2 × 16)
- m4 ≈ 1,5 g
Données : volume molaire : Vm = 22,4 L / mol dans les conditions de l'expérience.
Masses molaires : M (C)
= 12 g / mol ; M (O) = 16 g / mol ; M (H) =
1,0 g / mol ; M (Na) = 23 g / mol
Atome de sodium Na : Z = 11 ; atome d'oxygène O : Z = 8.
III- Propagation de la lumière.
1)- Un signal lumineux met 0,3 ms pour parcourir une distance de 60 km dans une fibre optique d'un réseau de télécommunications.
a)- Calculer la vitesse de propagation de la lumière dans le verre constituant la fibre optique.
- Vitesse de propagation de la lumière dans la fibre optique :
-


b)- Calculer l'indice de réfraction du verre constituant la fibre optique.
- Indice de réfraction du verre :
-
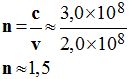
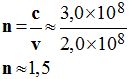
2)- Distance :
a)- Donner la définition de l'année-lumière (a.l).
- L'année-lumière a.l est la distance parcourue par la lumière en une année.
b)- À quelle distance une année-lumière correspond-elle ?
- Distance correspondante en mètre :
- 1 a.l ≈ 3 × 108 × 365,25 × 24 × 3600
-
1 a.l ≈ 9,47
× 1015
m
c)- La distance du centre du soleil au centre de la terre est de 150 millions de km. Exprimer cette distance en année-lumière (a.l), en minute-lumière (min.l).
- Distance Terre - Soleil en a.l. et en min.l
-
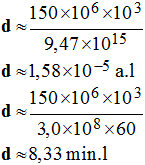
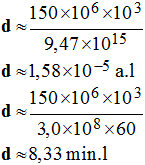
3)- La distance entre la terre et l'étoile la plus proche, Proxima du Centaure, est de 4,3 a.l.
a)- Calculer cette distance en km.
- Distance Terre Proxima du Centaure en km :
- d ≈ 4,3 × 9,47 × 1012 km
- d ≈ 4,07 × 1013 km
b)- Déterminer le temps mis par la lumière pour nous parvenir de cette étoile.
- Durée mise par la lumière pour nous parvenir de Proxima du Centaure :
- Δt = 4,3 ans
données : 1 année = 365,25 jours et c = 3,0 × 108 m / s