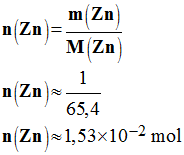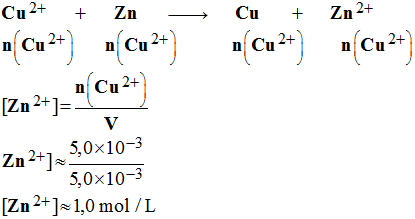|
Contrôle N° 02 Novembre 2000 Première S Énoncé et correction |
|
|
|
|
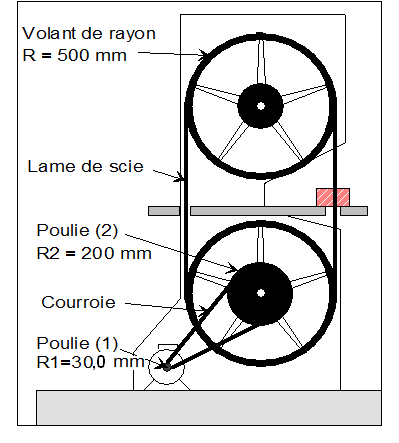
Une scie à ruban est entraînée par un moteur électrique. La vitesse de rotation de l’axe du moteur est de 4,80 × 103 tr / min. Une poulie (1) fixée sur l’axe de rotation tourne à la même vitesse angulaire que celui-ci. Cette poulie entraîne une courroie qui entraîne à son tour une seconde poulie (2). La courroie ne glisse sur aucune des poulies. La poulie (2) est solidaire d’un premier volant, comme le montre le schéma ci-dessous. Un second volant, identique au premier, est situé au-dessus de lui. La lame de la scie à ruban est tendue sur les deux volants et elle ne glisse sur aucun des deux volants.
1)- Calculer la vitesse angulaire ω1 de la poulie (1). (rad / s) - Vitesse angulaire ω1 de la poulie (1). (rad / s) -
2)- Calculer la vitesse v1 d’un point situé à la périphérie de la poulie (1). (m / s) - Vitesse v1 d’un point situé à la périphérie de la poulie (1). (m / s) - v1 = ω1 . R1 - v1 ≈ 5,03 × 102 × 30,0 × 10 – 3 - v1 ≈ 15,1 m / s 3)- En déduire la vitesse vC d’un point de la courroie. (m / s) - Vitesse vC d’un point de la courroie. (m / s) - Un point de la poulie se déplace à la même vitesse qu’un point de la courroie. - La courroie ne glisse pas sur la poulie. - vC = v1 ≈ 15,1 m / s 4)- Déterminer les vitesses angulaires ω2 et ωv de la poulie (2) et des volants. (rad / s) - Vitesses angulaires ω2 et ωv de la poulie (2) et des volants. (rad / s) - Un point de la poulie se déplace à la vitesse vC. -
- Le volant est solidaire de la poulie, ils tournent à la même vitesse et les deux volants ont le même rayon et de ce fait la même vitesse de rotation : - ω2 = ωv =75,4 rad / s 5)- Calculer la vitesse vS d’un point de la lame de scie en (m / s). - Vitesse vS d’un point de la lame de scie. (m / s) - vS = ωV . R => vS ≈ 75,4 x 0,500 - vS ≈ 37,7 m / s |
II- Utilisation d’une calculatrice.
|
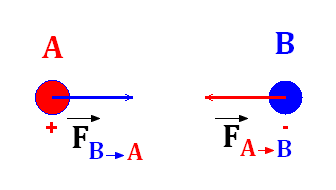
1)- Énoncer le principe de l'interaction. - Énoncer le principe de l'interaction. - Lorsqu'un corps A est en interaction avec un corps B, - la force
-
à la force
-
On écrit : -
Les deux forces ont même droite d'action.
-
Ce principe est vrai que les corps soient au repos ou en
mouvement.
-
Un objet de masse m = 350 g est maintenu par l'intermédiaire d'une ficelle (f). On note :
2)- Quelles sont parmi ces forces celles qui sont liées par le principe de l'interaction ? - Forces liées par le principe de l'interaction. -
-
-
3)- Comparer les
valeurs de
-
Comparaison des valeurs de
- Si l’on étudie l’objet, on remarque qu’il est soumis aux forces et. - Étant en équilibre, il est soumis à des forces dont les effets se compensent : -
- Les deux forces ont même droite d’action. -
De plus
-
- En conséquence : F1 = F2 = P. |
III- Il ne faut pas se précipiter.
|
Dans un premier tube à essais, on verse un volume V de solution de sulfate de cuivre II de concentration molaire C et on ajoute une masse m de zinc métal en poudre. Dans un deuxième tube à essais, on mélange un même volume V de solution de sulfate de zinc II de même concentration C avec une même masse m de cuivre métal en poudre. Dans le premier tube, la solution se décolore et un dépôt métallique de couleur rougeâtre se forme. Le contenu du deuxième tube n’a subit aucune modification apparente. Chaque solution est analysée par ajout de quelques gouttes de soude : un précipité blanc apparaît dans les deux cas. 1)- Quelle espèce chimique est mise en évidence par les tests effectués avec la soude ? Donner l’équation bilan de la réaction de précipitation. - espèce chimique mise en évidence par les tests effectués avec la soude. - Le test a pour but de mettre en évidence la présence d’un cation métallique, ici les ions Zinc II. - équation bilan de la réaction de précipitation.
Zn2+
(aq) +
2 HO–
(aq) →
Zn(OH)2
(s) 2)- Dans quel tube s’est-il produit une réaction chimique d’oxydoréduction ? Définir ce terme. - tube où se produit une réaction chimique d’oxydoréduction - Dans le premier tube, il se produit une réaction d’oxydoréduction. - Définir ce terme : - Une réaction d’oxydoréduction est une réaction de transfert d’électrons. 3)- Écrire les demi-équations électroniques et l’équation bilan de la réaction naturelle qui se produit.
4)- Indiquer quels sont le réducteur et l’oxydant et définir ces deux termes. - Le réducteur et l’oxydant et définitions. -
Le zinc métal est le réducteur
et l’ion cuivre
II est l’oxydant. -
Un oxydant est une espèce
chimique qui capte des électrons. - un réducteur est une espèce chimique qui cède des électrons. 5)- Donner les couples oxydant / réducteur présents et classer les pouvoirs oxydant des cations métalliques. Indiquer quel est l’oxydant le plus fort et le réducteur le plus fort. -
couples
oxydant / réducteur présents. -
Couples oxydant / réducteur :
Cu2+
/ Cu et
Zn2+
/ Zn. -
Classement des pouvoirs oxydant des cations métalliques -
Cu2+
est un oxydant plus fort que Zn2+ -
Zn
est un réducteur plus fort que Cu. -
oxydant
le plus fort et le réducteur le plus fort -
Cu2+
est l’oxydant le plus fort et Zn est le réducteur le plus fort 6)- Montrer que l’un des réactifs de cette réaction d’oxydoréduction est en défaut. Justifier votre réponse. - l’un des réactifs de cette réaction d’oxydoréduction est en défaut.
-
Quantité de matière de zinc :
-
-
Quantité de matière d’ions
cuivre
II :
-
n
(Cu2+)
= C . V
-
n
(Cu2+)
≈ 1,0
×
5,0
× 10
– 3
-
n
(Cu2+)
≈ 5,0
×
10
– 3 mol |
Tableau d’avancement :
|
Équation |
Cu2+ |
+ |
Zn |
→ |
Cu |
+ |
Zn2+ |
|
|
|
|
|
|
|
|
|
|
État initial |
n (Cu2+)
≈ 5,0
×
10 – 3 mol |
|
n (Zn)
≈ 1,53
×
10 – 2 mol |
|
0 |
|
0 |
|
État inter |
n (Cu2+)
– x |
|
n (Zn)
– x |
|
x |
|
x |
|
État final |
n (Cu2+)
– xmax |
|
n (Zn)
– xmax |
|
xmax |
|
xmax |
|
- L’avancement maximal xmax s’obtient en écrivant que les quantités de matière des réactifs restent positives ou nulles. - Il permet de déterminer l’état final de la transformation. - En général, la réaction s’arrête lorsque l’un des réactifs a été totalement consommé. - À l’état final, la quantité de matière du réactif limitant est nulle. - Pour compléter le tableau, il faut déterminer la valeur de xmax. - On peut calculer les deux valeurs de xmax en résolvant les deux équations suivantes |
|
n (Cu2+)
– xmax = 0 |
|
5,0
×
10 – 3 – xmax = 0 |
=> |
xmax1
≈ 5,0
× 10
– 3 mol |
|
n (Zn) – xmax = 0 |
1,53
× 10 – 2 – xmax = 0 |
xmax2 ≈ 1,52
× 10 –
2 mol |
|
- La valeur retenue pour x max est la plus faible des deux valeurs. - xmax = xmax1 ≈ 5,0 × 10 – 3 mol - Comme n (Cu2+) < n (Zn), les ions cuivre II sont en défaut, - ils limitent la réaction. -
En fin de réactions, les ions
cuivre
II ont disparu. |
|
Équation |
Cu2+ |
+ |
Zn |
→ |
Cu |
+ |
Zn2+ |
|
|
|
|
|
|
|
|
|
|
État initial |
n (Cu2+)
≈ 5,0
× 10 – 3 mol |
|
n (Zn)
≈ 1,53
× 10 – 2 mol |
|
0 |
|
0 |
|
État inter |
n (Cu2+)
– x |
|
n (Zn)
– x |
|
x |
|
x |
|
État final |
0 |
|
1,0
× 10 – 2 mol |
|
5,0
× 10 – 3 mol |
|
5,0
× 10 – 3 mol |
|
7)- Calculer la concentration des différentes espèces chimiques présentes dans chaque tube à essais en fin de réaction (avant d’effectuer le test avec la soude). - concentration des différentes espèces chimiques présentes dans chaque tube à essais en fin de réaction (avant d’effectuer le test avec la soude). -
- Données :
-
V
= 5,0 mL ; C = 1,0 mol / L ;
m = 1,0 g ;
-
M(Zn )
= 65,4 g / mol ; M(Cu ) = 63,5 g / mol |
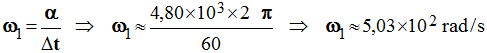
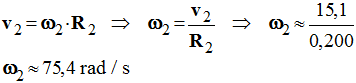

 ,
,