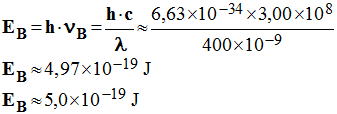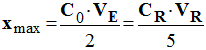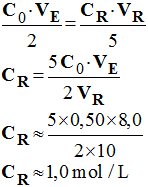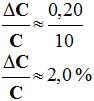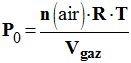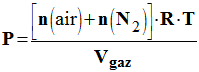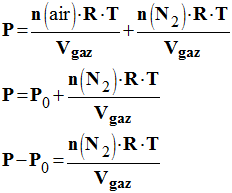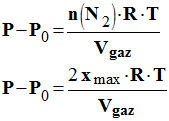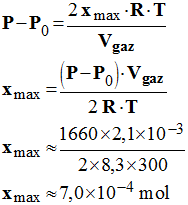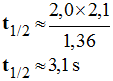|
Antilles 2011 : Bac Sciences Physiques Exercice 1 : Le luminol
au service de la police scientifique (6,5 pts)
C |
|
|
|
1. La lumière émise est une lumière bleue.
2. La réaction produite est une réaction d’oxydoréduction.
3. La réaction entre le luminol et l’eau oxygénée est une
transformation lente. |
Exercice 1 : Le luminol au service de la police scientifique (6,5 pts)
|
Le luminol ou 5-amino-2,3-dihydrophtalazine-1,4-dione est un composé organique de formule brute C8H7N3O2. Sa réaction, avec certains oxydants, conduit à l’émission d’une lumière d’un éclat bleu caractéristique. On parle de chimiluminescence.L’oxydant habituellement utilisé est l’eau oxygénée H2O2 (aq). On obtient alors après réaction des ions aminophtalate, du diazote et de l’eau. Les ions aminophtalate sont dans ce cas dans un état excité. Ils vont retrouver leur état de repos en « dégageant leur surplus d’énergie » sous forme de photons, ce qui se traduit par l’émission d’une lumière bleue. Toutefois cette réaction est très lente, elle se compte en mois… Par contre, elle se produit rapidement en présence d’un composé ferrique, c’est-à-dire un composé contenant des ions fer III. |
|
L’hémoglobine des globules rouges du sang contient des ions fer III. Le luminol va servir à déceler des traces de sang, même infimes, diluées par lavage ou séchées. Après avoir assombri les lieux, les techniciens de la police scientifique pulvérisent un mélange de luminol et d’eau oxygénée. Au contact des endroits où du sang est tombé, des chimiluminescences apparaissent avant de s’éteindre environ 30 s après. Un appareil photo mis en pose lente permet de localiser ces traces. D’après le site : http:/la-science-rattrape-jack |
|
- Vitesse de la lumière dans le vide : c = 3,00 × 108 m / s - Constante de Planck : h = 6,63 × 10 – 34 J . s - La loi des gaz parfaits s’écrit : P.V = n.R.T - Constante des gaz parfaits : R = 8,3 SI |
|
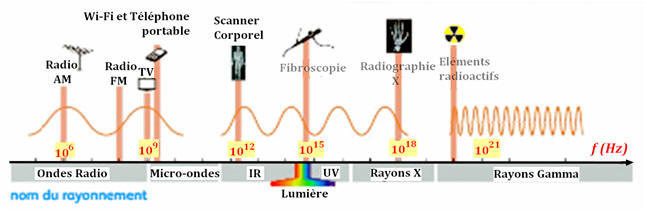
1. La lumière émise est une lumière bleue. 1.1. Quelques définitions. 1.1.1. À quel domaine, mécanique ou électromagnétique, une onde lumineuse appartient-elle ? - L’onde lumineuse appartient au domaine électromagnétique. - L’onde lumineuse résulte de la propagation d’une perturbation électromagnétique dans les milieux transparents.- Les ondes lumineuses périodiques sont appelées des radiations. |
|
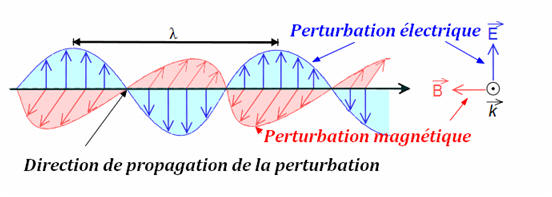
1.1.2. Concernant le milieu de propagation, en quoi ces deux types d’onde se différencient-ils ? - L’onde lumineuse résulte de la propagation simultanée d’une perturbation électrique et d’une perturbation magnétique. - Une onde mécanique correspond à la propagation d’une perturbation dans un milieu matériel sans transport de matière. - C’est pour cela que l’on dit qu’un mobile se déplace alors qu’une onde se propage. - Contrairement aux ondes mécaniques, la propagation des ondes lumineuses ne nécessite pas de support matériel. - La lumière peut se propager dans le vide. |
|
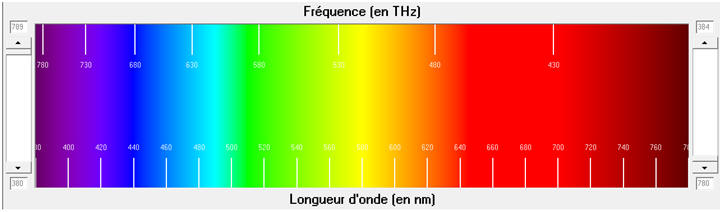
1.2. La longueur d’onde émise est voisine de 400 nm. 1.2.1. Quelle énergie un photon émis transporte-t-il lors de la désexcitation des ions aminophtalate ? - Énergie d’un photon émis lors de la désexcitation des ions aminophtalate : -
|
|
1.2.2. Cette valeur serait-elle plus élevée si la lumière émise était rouge ? Justifier. - Cas d’une lumière rouge :
- La longueur d’onde d’une radiation rouge λR > λB longueur d’onde d’une radiation bleue - En conséquence, en se qui concerne les fréquences : νR < νB - Comme : ER = h. νR et que νR < νB, alors : ER < EB |
|
2. La réaction produite est une réaction d’oxydoréduction. L’équation de la réaction s’écrit : 2 C8H7N3O2 (aq) + 7 H2O2 (aq) + 4 HO– (aq) = 2 N2 (g) + 2 C8H2N3O42– (aq) + 14 H2O (ℓ) Pour illustrer cette réaction, trois solutions sont préparées : - Une solution S1 avec 1,0 g de luminol, 250 g d’hydroxyde de sodium NaOH (s) et de l’eau distillée. - Une solution S2 avec 5,0 g de ferricyanure de potassium K3Fe(CN)3 (s) et 250 mL d’eau distillée. - Une solution S3 constituée de 0,50 mL d’eau distillée à 110 volumes. Les solutions S1 et S2 sont mélangées dans un bécher puis la solution S3 est ajoutée. Le mélange réactionnel a un volume V = 350 mL. 2.1. L’eau oxygénée joue le rôle d’oxydant. Qu’appelle-t-on oxydant ? - Un oxydant : - Un oxydant est une entité chimique capable de gagner un ou plusieurs électrons. - (Oxydant : gagne) - Ox + n e – = Red - Au cours d’une réaction d’oxydoréduction, l’oxydant est réduit et le réducteur oxydé. |
|
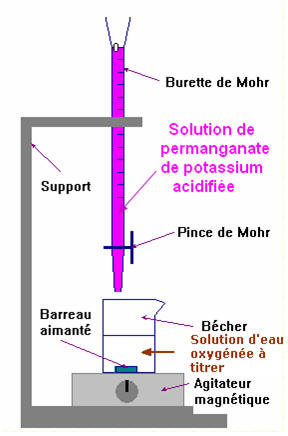
2.2. Le titre d’une eau oxygénée exprime le volume de dioxygène (mesuré en litres dans les conditions normales de température et de pression) que peut libérer un litre d’eau oxygénée lors de la réaction de dismutation : 2 H2O2 (aq) = O2 (g) + 2 H2O (ℓ) Ainsi, une eau oxygénée à 110 volumes a une concentration molaire C = 9,8 mol / L. On veut vérifier la concentration molaire de la solution d’eau oxygénée à 110 volumes. Cette solution est diluée 10 fois. On obtient la solution SR de concentration CR. Un prélèvement VR = 10 mL de cette solution est dosé par une solution de permanganate de potassium acidifiée de concentration molaire C0 = 0,50 mol / L. Les couples mis en jeu sont les suivants : MnO4– (aq) / Mn2+ (aq) et O2 (aq) / H2O2 (aq) 2.2.1. Écrire la réaction support du dosage. - Réaction support du dosage : - Couple : Mn O4 – (aq) / Mn 2+ (aq) :
- Le couple : O2 (aq) / H2O2 (aq)
- Équation bilan : Cliquer sur l'image pour l'agrandir |
|
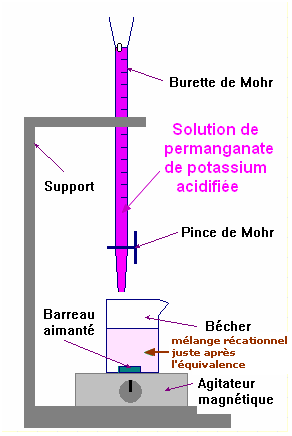
2.2.2. Rappeler la définition de l’équivalence. Comment l’équivalence est-elle repérée dans ce dosage ? - Définition de l’équivalence : - à l’équivalence, les réactifs sont dans les proportions stœchiométriques définies par les coefficients de la réaction. - à l’équivalence, il n’y a pas de réactif limitant. - Repérage de l’équivalence : - Les ions permanganate MnO4 – (aq) donnent une couleur violette à la solution qui les contient. - Les ions Mn 2+ (aq) sont incolores. - La solution aqueuse d’eau oxygénée est incolore. - La solution de permanganate de potassium (K + (aq) + MnO4 – (aq)) acidifiée se décolore presque immédiatement en présence d’eau oxygénée. - À l’équivalence, on observe la persistance de la coloration violette Avant Après - Le volume versé à l’équivalence est connu à la goutte près (ordre de grandeur de 0,05 mL à 0,10 mL) 2.2.3. Le volume de solution de permanganate de potassium acidifié versé à l’équivalence est VE = 8,0 mL. En déduire la concentration CR de la solution diluée SR et vérifier que la concentration de la solution d’eau oxygénée à 110 volumes est voisine de celle annoncée. (On pourra s’aider d’un tableau d’avancement). |
Tableau d’avancement :
|
Équation |
2
MnO4– (aq) |
+
5 H2O2 (aq) |
+
6
H+
(aq) |
→ |
2
Mn2+
(aq) |
+
5 O2 (aq) |
+
8 H2O
(ℓ) |
|
|
État |
Avanc. |
|||||||
|
É.I
(mol) |
n1
= C0.V |
nR |
Excès |
0 |
0 |
Solvant |
||
|
Équi. |
n1
= C0.VE |
nR
= CR.VR |
Excès |
0 |
0 |
Solvant |
||
|
Au
cours |
C0.V
– 2 x |
CR.VR
– 5 x |
x |
5 x |
Solvant |
|||
|
É.F
(mol) |
C0.V
– 2 xmax |
CR.VR
– 5 xmax |
2 xmax |
5 xmax |
Solvant |
|||
|
Équi. |
C0.VE
– 2 xmax = 0 |
CR.VR
– 5 xmax = 0 |
|
|
2 xmax |
5 xmax |
Solvant |
|
|
- Relation à l’équivalence : -
- Valeur de la concentration CR de la solution diluée SR : -
- Concentration molaire de la solution d’eau oxygénée à 110 volumes : - Vérification expérimentale : - Comme la solution a été diluée 10 fois : - C = 10 CR - C ≈ 10 mol / L - Ce résultat est en accord avec la concentration molaire effective de la solution d’eau oxygénée à 110 volumes qui est de 9,8 mol / L. - Différence relative : -
- Le résultat est correct. - Ne pas oublier que l’on a effectué un dosage colorimétrique et que l’instrument de mesure est l’œil. |
|
3. La réaction entre le luminol et l’eau oxygénée est une transformation lente. La réaction entre le luminol et l’eau oxygénée est réalisée maintenant dans une enceinte fermée. On rappelle que le mélange réactionnel a un volume V = 350 mL. La formation de diazote crée une surpression qui s’additionne à la pression de l’air initialement présent. Grâce à un capteur de pression, on mesure on fonction du temps, la valeur de la pression P à l’intérieur de l’enceinte. Soit P0 la pression due à l’air régnant initialement dans l’enceinte, T = 300 K la température du milieu (supposée constante durant l’expérience) et Vgaz = 2,1 L le volume de gaz contenu dans l’enceinte. Tous les gaz sont considérés comme parfaits. 3.1.
3.1.1. Exprimer P0 en fonction de n (air), Vgaz, R et T si n (air) est la quantité de matière d’air initialement présente dans l’enceinte. Soit n (N2), la quantité de matière de diazote formé au cours de la transformation
- Expression de P0 en fonction de n (air), Vgaz, R et T. - La loi des gaz parfaits s’écrit : P.V = n.R.T - Dans le cas qui nous intéresse : - P0. Vgaz = n (air).R.T -
|
|
3.1.2. Exprimer P en fonction de n (air), n (N2), Vgaz, R et T. - Expression de P en fonction de n (air), n (N2), Vgaz, R et T - P. Vgaz = [n (air) + n (N2)].R.T -
|
|
3.1.3. En déduire l’expression de la surpression (P – P0). - Expression de la surpression (P – P0). -
|
|
3.2. Soit n1 et n2 les quantités de matière de luminol et d’eau oxygénée. Les ions hydroxyde HO– (aq) sont introduits en excès. Compléter le tableau d’avancement simplifié donné en document 1 sur l’annexe page 8/8 à rendre avec la copie. Déterminer la valeur de l’avancement maximum noté xmax. Dans ce tableau, la quantité de diazote correspond exclusivement au diazote produit par la réaction. - Valeur de l’avancement maximum noté xmax :
- Hypothèse 1 : On suppose que le luminol C8H7N3O2 (aq) constitue le réactif limitant : - Alors : 5,6 × 10– 3 – 2 xmax1 = 0 - xmax1 ≈ 2,8 × 10–3 mol - Hypothèse 2 : On suppose que l’eau oxygénée H2O2 (aq) constitue le réactif limitant : - Alors : 4,9 × 10– 3 – 7 xmax2 = 0 - xmax2 ≈ 7,0 × 10 –4 mol - L’avancement maximal est égal à la plus petite des deux valeurs - xmax = xmax2 = 7,0 × 10 –4 mol < xmax2 - Le réactif limitant est l’eau oxygénée H2O2 (aq). - Tableau d’avancement : |
|||||||||||||||||||||||||||||||||||||
|
Équation |
2 C8H7N3O2 (aq) |
+ 7 H2O2 (aq) |
+ … |
= |
+ 2 N2 (g) |
+ … |
|
|
État |
Avancement mol |
|
|
|
|
|
|
|
État
initial |
0 |
n1 = 5,6 × 10– 3 mol |
n2 = 4,9 × 10– 3 mol |
|
0 |
|
|
|
État
intermédiaire |
x |
n1
– 2 x |
n2
– 7 x |
|
2 x |
|
|
|
État
final |
xmax
= 7,0
× 10 –4 |
4,2 × 10 – 3 mol |
0 |
|
1,4
× 10
–
3 mol |
|
|
|
3.3. Établir la relation entre l’avancement x de la réaction, la surpression (P – P0), Vgaz, R et T. - Relation entre l’avancement x de la réaction, la surpression (P – P0), Vgaz, R et T : -
|
|
3.4. On mesure, dans l’état final, une surpression de 1660 Pa. Retrouver la valeur xmax de l’avancement maximal. - Valeur xmax de l’avancement maximal à partir de la connaissance de la valeur de la surpression : - |
|
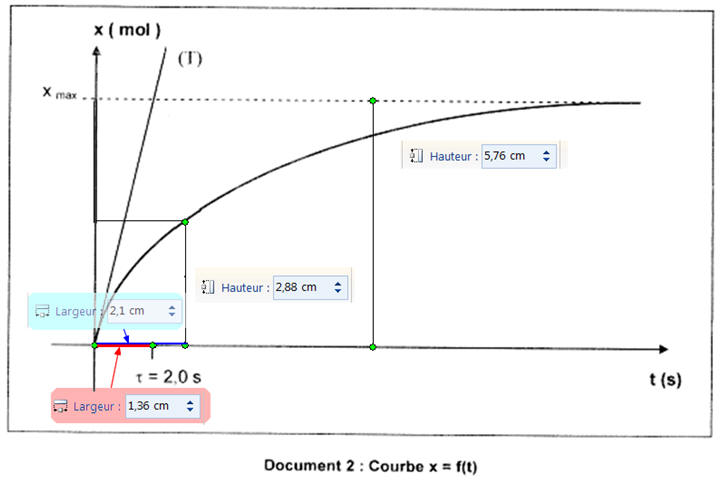
3.5. Un logiciel permet de traiter les mesures de pression P afin d’obtenir la courbe x = f (t) donnée en document 2 sur l’annexe page 8/8 à rendre avec la copie. La tangente (T) à l’origine a été tracée. 3.5.1. La vitesse volumique de réaction à la date t est donnée par la relation :
Comment évolue cette vitesse en fonction du temps ? Comment expliquer cette évolution ?
- La vitesse volumique de réaction diminue au cours du temps car le coefficient directeur de la tangente à la courbe diminue avec le temps. - En fin de réaction, la tangente à la courbe est pratiquement horizontale. - La vitesse de formation d’un produit augmente avec la concentration des réactifs. - On dit que la concentration des réactifs est un facteur cinétique. - Or au cours de la réaction, la concentration des réactifs diminue, en conséquence, la vitesse volumique d’une réaction diminue généralement avec le temps. |
|
3.5.2. Définir le temps de demi-réaction t ½ et le déterminer approximativement à partir de la courbe x = f (t). - Définition du temps de demi-réaction : - Le temps de demi-réaction correspond à la durée au bout de laquelle l’avancement atteint la moitié de sa valeur finale : -
- Lorsque la réaction est totale : -
- Valeur du temps de demi-réaction t ½ :
-
|
|
4.2. Expliquer, en deux ou trois lignes pourquoi cette transformation, dont la vitesse est accrue, est intéressante en criminologie. - Cette transformation est intéressante en criminologie car : - La transformation étant très lente, on peut déceler la présence de sang sur les lieux d’un crime longtemps après les faits. - Cette transformation est très sensible. - Le luminol est très sensible aux taches de sang ou de résidus, même pour les taches anciennes, dans les murs, les tapis, tissus d'ameublement, les planchers en bois, ou les surfaces peintes. - On peut mettre en évidence le sang même s’il est présent en très faible quantité, après nettoyage de la scène de crime. - Remarque : si une scène de crime est soigneusement nettoyée à l'aide d'une solution diluée d'eau de Javel, celle-ci va devenir entièrement fluorescente, camouflant les éventuelles traces organiques comme le sang.
Luminol mélangé à du sang |
-
Annexe de l’exercice 1 :
|
Équation |
2 C8H7N3O2 (aq) |
+ 7 H2O2 (aq) |
+ … |
= |
+ 2 N2 (g) |
+ … |
|
|
État |
Avancement |
|
|
|
|
|
|
|
État initial |
0 |
n1 = 5,6 x 10 – 3 mol |
n2 = 4,9 x 10 – 3 mol |
|
|
|
|
|
État intermédiaire |
x |
|
|
|
|
|
|
|
État final |
xmax |
|
|
|
|
|
|
Tableau d’avancement simplifié
|
|
|
|