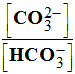|
Bac Blanc Janvier 2000 Chimie |
|
|
| Exercice 4 | Eau d'alimentation et eau de chaux (4 pts) Énoncé Correction |
|
|
|
Dans les eaux d’alimentation, l’alcalinité est due principalement à la présence d’ions carbonate CO32– et d’ions hydrogénocarbonate HCO3– . On donne les couples acido-basiques suivants ainsi que leurs pKA respectifs :
On note (CO2,
H2O /
HCO3–) l’acide conjugué de l’ion
hydrogénocarbonate. 1. On considère une eau d’alimentation dont le pH est de 8,0. Donner la définition du pKA du couple mettant en jeu l’ion carbonate et calculer sa valeur. Pour ce couple, calculer le rapport :
2. Pour mettre en évidence la présence d’ions carbonate dans une eau d’alimentation, on ajoute une solution d’acide chlorhydrique : du dioxyde de carbone se dégage. - Placer tous les couples acido-basiques sur un axe des pKA et indiquer en les soulignant les espèces présentes. - Écrivez les deux équations bilans des réactions expliquant le dégagement de dioxyde de carbone. - Calculez leur constante de réaction. Peut-on considérer ces réactions comme totales ? - Quelle est la particularité de l’ion hydrogénocarbonate ? Donnez son qualificatif. |
4. Application :
|
Expliquer pourquoi une eau riche en dioxyde de carbone, ruisselant lentement, est capable de creuser des fissures ou des grottes dans les roches calcaires (essentiellement formées de CaCO3). |
![]()