|
|
|
|
1)- Équilibrer la réaction suivante 2)- Exercice 12 page 103. Équilibrer en milieu acide |
Équilibrage des réactions d'oxydoréduction en solution aqueuse.
1)- Équilibrer la
réaction suivante :
les ions nitrate en milieu
acide attaque le cuivre métal pour donner un
dégagement de monoxyde d'azote et des ions cuivre II.
|
2 (
NO3– (aq)
+ 4
H
+ (aq) + 3
e
–
=
NO
(g)
+
2
H2O
(ℓ))
|
|
3 (
Cu
(s)
= Cu 2+
(aq)
+
2
e
–
) |
|
2
(
NO3–
(aq)
+ 4
H
+ (aq) + 3
e
–
=
NO
(g)
+
2
H2O
(ℓ
)
|
|
2
NO3–
(aq) +
8
H
+ (aq)
+
3
Cu
(s) →
2
NO
(g)
+
4
H2O
(ℓ)
+
3
Cu
2+
(aq) |
Anciennne écriture
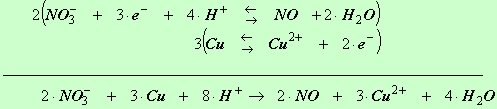
2)- Exercice 12 page 103. Équilibrer en milieu acide.
Équilibrer en milieu acide les demi-équations électroniques des couples oxydant / réducteur suivants :
MnO4– / MnO2 ; HCO / Cl – ; SO42– / SO2
Solutions :
|
|
Demi-équation électronique |
|
Première étape : On écrit le couple
oxydant / réducteur |
MnO4– =
Mn
2+
|
|
Deuxième étape : On équilibre l’élément oxygène
avec de l’eau |
MnO4– =
Mn
2+
+
4
H2O |
|
Troisième étape : On équilibre l’élément hydrogène avec H + (on travaille ainsi
en milieu acide)
|
MnO4– +
8
H
+
= Mn
2+
+
4
H2O |
|
Quatrième étape : On équilibre les charges
avec les électrons. |
MnO4– +
8
H
+
+
5
e
–
=
Mn
2+
+
4
H2O |
Anciennne écriture
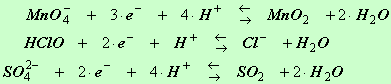
3)- Exercice 13 page 103. Mélange de solutions.
à 25 °C, on donne :
-
E0
(Cl2 /
Cl –) = 1,36 V
;
E0 (Br2
/ Br –) = 1,08 V
;
E0 (I2
/ I –) = 0,62 V
1)- Que se passe-t-il si l'on mélange des solutions :
a)- d'iodure de potassium et de dichlore ?
b)- de bromure de potassium et de diiode ?
c)- d'iodure de potassium et de dibrome ?
2)- écrire le cas échéant, l'équation bilan des réactions.
Solutions :
a)-
|
Mélange d’iodure de potassium et de
dichlore : |
|||||||
|
2
I– |
+ |
Cl2 |
|
→ |
I2 |
+ |
2 Cl– |
b)- rien
|
Mélange de bromure de potassium et de
diiode: |
|||||||
|
Br– |
+ |
I2
|
|
→ |
Rien |
|
|
c)-
|
Mélange d'iodure de potassium et de
dibrome: |
|||||||
|
2
I– |
+ |
Br2
|
|
→ |
I2 |
+ |
2 Br– |
4)- Exercice 21 page 104. Équilibre en milieu acide.
Équilibrer en milieu acide les demi-équations électroniques des couples oxydant / réducteur suivants :
-
Cr2O72–
/ Cr3+ ;
O2 /
H2O2
; H2CO
/ CH3OH
Solutions :
|
Cr2O72– |
+ |
6
e– |
+ |
14
H+ |
=
|
Cr3+
|
+ |
7
H2O |
|
O2 |
+ |
2
e– |
+ |
2
H+ |
=
|
H2O2 |
|
|
H2CO |
+ |
2
e– |
+ |
2
H+ |
=
|
CH3OH
|
Anciennne écriture
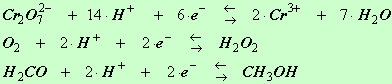
|
|
|
|