|
QCM N° 14 |
Ressources énergétiques. |
|
|
|
|
QCM N° 14 :
Ressources énergétiques.
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une ressource énergétique renouvelable est exploitable : |
sans intervention
humaine. |
sans limitation
de durée. |
sans impact
environnemental. |
B |
|
2 |
Les réserves d’une ressource énergétique non renouvelable : |
s’épuisent à court ou
moyen terme. |
ne s’épuiseront
jamais. |
se reconstituent rapidement à l’échelle
humaine. |
A |
|
3 |
Lorsque les pales d’uneéolienne sont en mouvement : |
de l’énergie mécanique peut être convertie en
énergie électrique. |
l’éolienne exploite une ressource énergétique
renouvelable. |
l’éolienne exploite une ressource énergétique
fossile. |
AB |
|
4 |
De l’énergie chimique est stockée dans : |
la biomasse. |
un noyau
fissile. |
un gisement
naturel. |
AC. |
|
5 |
L’énergie chimique :
|
peut être convertie en
énergie thermique. |
est liée à la rupture et à la formation de liaisons
covalentes. |
est liée à la rupture et à la formation de liaisons entre nucléons. |
AB |
|
6 |
Les feuilles d’un végétal : |
convertissent de l’énergie rayonnante en énergie
chimique. |
convertissent de l’énergie chimique en énergie
rayonnante. |
stockent de l’énergie
chimique. |
AC |
|
7 |
Une réaction de combustion complète peut libérer : |
du dioxyde
de carbone. |
du
carbone. |
de
l’énergie. |
AC |
|
8 |
La réaction de combustion du bois dans l’air est possible : |
grâce au diazote présent
dans l’air. |
grâce au dioxygène présent dans
l’air. |
grâce à la vapeur d’eau présente dans
l’air. |
B |
|
9 |
La réaction combustion complète du méthanol liquide a pour
équation : |
2 CH3OH (ℓ) + 2 O2 (g) → 2 CO2 (g) + 3 H2O (g) |
2 CH3OH (ℓ) + 3 O2 (g) → 2 CO2 (g) + 4 H2O (g) |
2 CH3OH (ℓ) + O2 (g) → 2 CO2 (g) + 4 H2O (g) |
B |
|
10 |
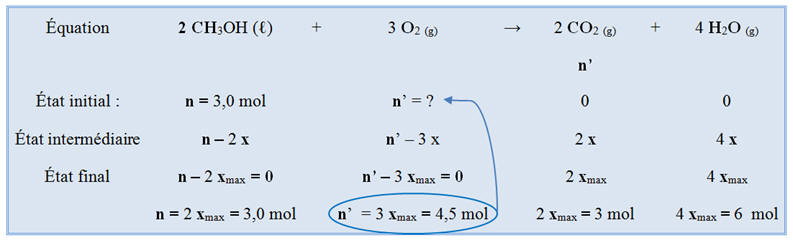
La réaction de combustioncomplète de 3 mol de méthanol CH3OH :
|
consomme 3 mol de
dioxygène. |
produit 3 mol de dioxyde de
carbone. |
s’accompagne de la libération
de 2 x 103
kJ. |
BC |
►
Ressources renouvelables ou non.
-
La distinction entre ressources énergétiques
renouvelables ou non est liée essentiellement à la :
-
Durée d’exploitation,
-
Et à la durée de reconstitution de la
ressource exploitée.
►
Une définition pour la ressource
renouvelable :
-
Lorsque le stock de ressource énergétique se
reconstitue aussi vite qu’il ne disparaît ou lorsque cette ressource est
quasi illimitée (à notre échelle de temps),
-
On dit que cette ressource est renouvelable.
-
Une ressource énergétique renouvelable est
exploitable sans limitation de durée.
-
Exemples de ressources renouvelables :
-
L’hydraulique, l’éolien, la géothermie, la
biomasse, le solaire.
►
Ressource non renouvelable :
-
Lorsque le stock de ressource énergétique se
reconstitue beaucoup moins vite qu’il ne disparaît ou lorsque cette
ressource ne se reconstitue pas du tout,
-
On dit que cette ressource est non
renouvelable.
-
Les réserves d’une ressource énergétique non
renouvelable s’épuisent à court ou moyen terme.
-
Exemples de ressources non renouvelables :
-
Ressources d’origine fossile : charbon,
pétrole, gaz
-
Ressource d’origine nucléaire : uranium.
►
Énergie éolienne.
-
Mouvement de l’air (vent)

-
Ressources : Énergie renouvelable.
►
La biomasse.
-
Utilisation des végétaux.

-
Ressources :
-
Durée de croissance des végétaux.
-
Renouvelable.
►
Énergie nucléaire.
-
Fission de l’uranium 235
-
Ressources :
-
Les ressources fissiles, comme l’uranium sont
évaluées à 100 ans.
►
Énergie chimique fossile.
-
Charbon, pétrole et gaz naturel.

-
Ressources :
-
200 ans pour le charbon
-
60 ans pour le gaz naturel
-
40 ans pour le pétrole.
►
Énergie chimique.

-
L’énergie chimique est liée à la rupture et à
la formation de liaisons covalentes.
►
La photosynthèse :
-
Dans les feuilles vertes des végétaux se
produit une réaction chimique appelée photosynthèse
-
Les plantes, par la photosynthèse, assurent
la conversion de l’énergie rayonnante de la lumière en énergie chimique.
-
Elles forment un réacteur chimique.
-
Une partie des radiations de la lumière du
Soleil est absorbée par la chlorophylle contenue dans les feuilles.
-
Cette énergie permet la réaction entre le
dioxyde de carbone atmosphérique et l’eau.
-
Il se
forme alors du dioxygène et du glucose.
6 CO2 + 6
H2O → 6 O2 +
C6H12O6
La photosynthèse
Ressource Wikipédia
Copier le lien : https://fr.wikipedia.org/wiki/Photosynthèse
►
Combustion complète :
-
Exemple : Combustion complète du butane :
2 C4H10
(g) + 13 O2 (g) →
8 CO2 (g) + 10 H2O
(ℓ)
-
La réaction de combustion nécessite du
dioxygène.
-
La combustion du bois utilise le dioxygène de
l’air.
►
Combustion incomplète :
-
Lorsque l’apport en dioxygène est
insuffisant, la combustion devient incomplète et d’autres espèces
chimiques peuvent se former : le carbone C (fine poudre noire)
-
Ou le monoxyde de carbone CO (gaz
toxique).
-
Il convient alors d’écrire une équation
chimique pour chaque espèce carbonée formée.
-
Énergie libérée lors de la combustion : une
combustion fournit de l’énergie thermique.
-
Les énergies thermiques molaires sont de
l’ordre de 103 à 104 kJ / mol.
-
Elles sont 102 à 103
plus grandes que celles de changement d’état.
-
Ceci est dû à la nature des liaisons qui se
rompent et se forment.
-
Lors d’un changement d’état, il s’agit de
liaisons intermoléculaires (Van der Waals ou hydrogène)
-
Lors de réactions chimiques,
il s’agit de liaisons covalentes.
►
Combustion complète du méthanol :
-
Elle consomme du dioxygène gazeux.
-
Elle libère du dioxyde de carbone à l’état
gazeux et de la valeur d’eau.
-
Équation de la réaction :
2 CH3OH (ℓ) + 3
O2 (g) → 2 CO2
(g) + 4 H2O
(g)
►
Énergie libérée lors de la combustion : une
combustion fournit de l’énergie thermique.
-
Les énergies thermiques molaires sont de
l’ordre de 103 à 104 kJ / mol.
-
Elles sont 102 à 103
plus grandes que celles de changement d’état. Ceci est dû à la nature des
liaisons qui se rompent et se forment.
-
Lors d’un changement d’état, il s’agit de
liaisons intermoléculaires (Van der Waals ou hydrogène)
-
Lors de réactions chimiques, il s’agit de
liaisons covalentes.
►
Tableau d’avancement : Combustion de 3 mol de
méthanol
|
|