|
QCM N° 10 a |
Dissolution de composés ioniques et moléculaires |
|
|
|
|
QCM N° 09 a
Dissolution de composés ioniques et moléculaires :
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
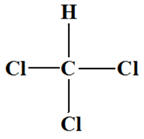
Le trichlorométhane de formule CHCl3 est une molécule polaire.
χ (Cl) = 3,2 ;
χ (H)
= 2,2 |
Les positions moyennes des charges positives et négatives sont
confondues. |
Les atomes de chlore portent une charge partielle
positive. |
La molécule de trichlorométhane possède des liaisons
polarisées. |
C |
|
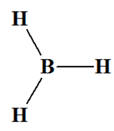
2 |
Le borane de formule BH3 est une molécule :
χ (B) = 2,0 ;
χ (H)
= 2,2 |
apolaire. |
polaire. |
dont les positions moyennes des charges positives et négatives sont
confondues. |
AC |
|
3 |
L’isooctane, de formule
C8H18
est un solvant : χ (C) = 2,55 ; χ (H)
= 2,20 |
apolaire. |
polaire. |
composé de molécules possédant des liaisons très
peu polarisées. |
AC |
|
4 |
Lors de la dissolution d’un solide ionique dans l’eau, les ions : |
se dissocient du solide
ionique. |
sont
hydratés. |
se dispersent dans la
solution. |
ABC |
|
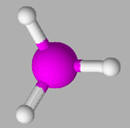
5 |
L’ion
ci-dessous est :
|
un
anion. |
un
cation. |
hydraté. |
AC |
|
6 |
L’éthanol ( CH3 – CH2 – OH ) est constitué de molécule polaire. Il
est : |
soluble
dans l’eau. |
insoluble
dans l’eau. |
soluble dans un solvant
polaire. |
AC |
|
7 |
L’hexane, de formule C6H14,
est : |
soluble
dans l’eau. |
soluble dans un solvant
polaire. |
soluble dans un solvant
apolaire. |
C |
|
8 |
L’équation de dissolution du cuivre (II), CuCl2 (s), dans l’eau s’écrit : |
CuCℓ2 (s) → Cu2+ (aq) + Cℓ– (aq) |
CuCℓ2 (s) → 2 Cu+ (aq) + 2 Cℓ– (aq) |
CuCℓ2 (s) → Cu2+ (aq) + 2 Cℓ– (aq) |
C |
|
9 |
L’équation de dissolution du nitrate de fer (III) est :
|
contient autant d’ions fer (III), Fe3+ que d’ions nitrate,
NO3– |
contient trois fois plus d’ions fer (III), Fe3+ que d’ions
nitrate, NO3–. |
contient trois fois plus d’ions nitrate, NO3– que d’ions fer (III),
Fe3+. |
C |
|
10 |
On souhaite préparer 1,00 L d’une solution aqueuse de nitrate de fer (III) dont la concentration en ions nitrate est : [NO3–] = 1,0 × 10–1 mol / L. Le nitrate de fer Fe(NO3)3 (s) est un solide ionique de massemolaire M = 242 g / mol. L’équation de dissolution du nitrate de fer dans l’eau est la
suivante :
La valeur de la masse, de nitrate de fer (III) nécessaire, pour préparer cette solution est : |
m
= 24 ,2 g |
m
= 8,07 g |
m
= 72,6 g |
B |
►
Liaison polarisée et molécules polaires
et apolaires:
-
Molécule diatomique :
-
Une molécule, constituée de deux atomes A
et B, est polarisée si ces deux atomes ont des électronégativités
différentes.
-
La molécule A – B est une molécule
polaire. Elle possède un moment dipolaire
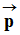 .
.
-
Molécule polyatomique
possédant plus de deux atomes :
-
Une molécule est polaire si elle possède un
moment dipolaire
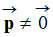 .
.
-
Une molécule est apolaire si son moment
dipolaire
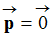
-
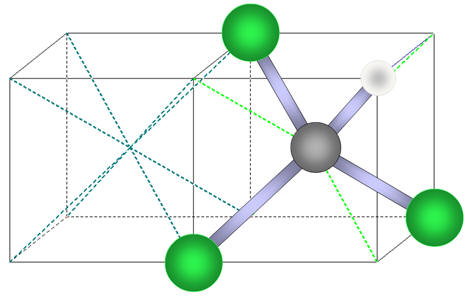
La molécule de trichlorométhane :
molécule polaire
-
La liaison C – Cl est polarisée car
l’atome de chlore est plus électronégatif que l’atome de carbone.
-
La liaison C – H est très peu
polarisée.
-
Moment dipolaire de la molécule de
trichlorométhane :
-
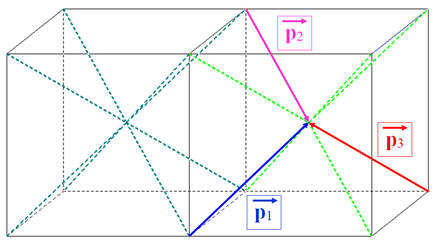
Le moment dipolaire résultant est égal à la
somme vectorielle des moments dipolaires des trois liaisons C – Cl :
-
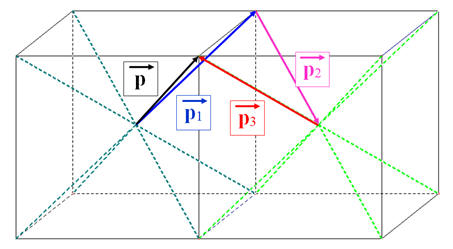
 .
.
-
Comme
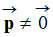 , la
molécule de trichlorométhane est polaire.
, la
molécule de trichlorométhane est polaire.
-
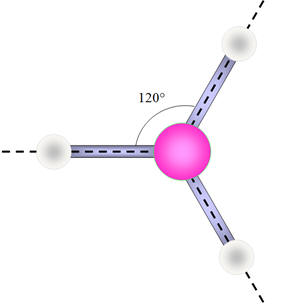
La molécule de borane : molécule
apolaire.
-
La liaison B – H est (faiblement) polarisée car
l’atome de bore est plus électronégatif que l’atome d’hydrogène.
-
Moment dipolaire de la molécule de borane :
-
Le moment dipolaire résultant est égal à la
somme vectorielle des moments dipolaires des trois liaisons B – H :
-
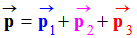 .
.
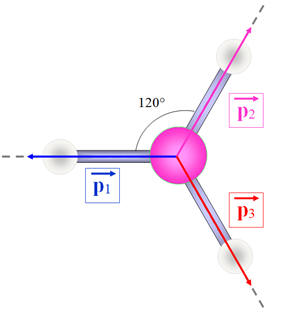 Et
Et 
-
Comme
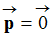 , la molécule
de trichlorométhane est apolaire.
, la molécule
de trichlorométhane est apolaire.
►
Solvant polaire et apolaire :
-
Solvant polaire :
-
Un solvant constitué de molécule polaire est
un solvant polaire.
-
Solvant apolaire :
-
Un solvant constitué de molécule apolaire est
un solvant apolaire.
-
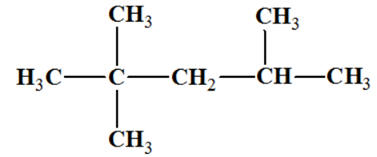
La molécule d’isooctane :
-
Le 2,2,4-triméthylpentane, ou isooctane, est
un hydrocarbure de formule brute C8H18
.C'est un isomère
de l'octane.
-
Formule semi-développée :
-
La différence d’électronégativité entre
l’atome de carbone et l’atome d’hydrogène est faible (χ
(C) = 2,55 ;
χ
(H) = 2,20)
-
On peut admettre, comme les liaisons C – H
sont très peu polarisées que :
-
Les solvants dont les molécules ne comportent
que des atomes de carbone et d’hydrogène sont apolaires.
-
Ceci, même en l’absence de symétrie de la
molécule.
►
Dissolution d’un composé ionique dans l’eau :
-
L’eau H2O
est un solvant polaire. La molécule d’eau est une molécule polaire.
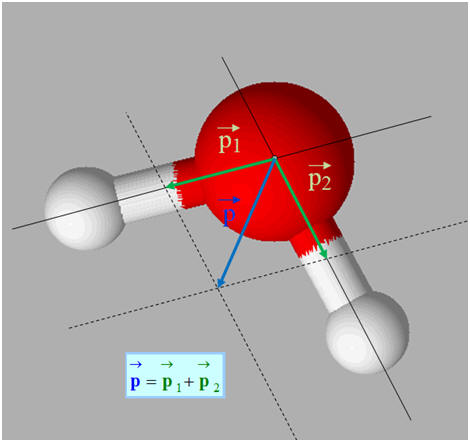
-
La dissolution d’un cristal ionique dans un
solvant polaire se déroule en 3 étapes :
-
La dissociation des ions du solide ;
-
La solvatation des ions ;
-
La dispersion des ions dans le solvant.
-
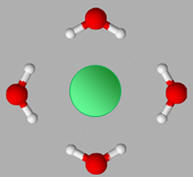
Exemple : pour le chlorure de sodium
-
Les ions sodium Na+ et les
ions chlorure Cl– s’entourent d’un cortège de molécules
d’eau. Ils sont hydratés.
-
Pour les anions la disposition des molécules
d’eau est la suivante :
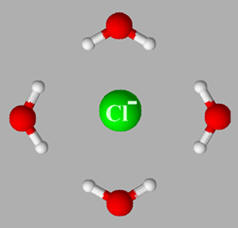
-
Pour les cations la disposition des molécules
d’eau est la suivante :
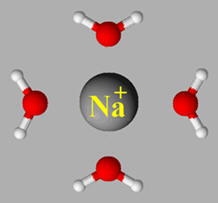
►
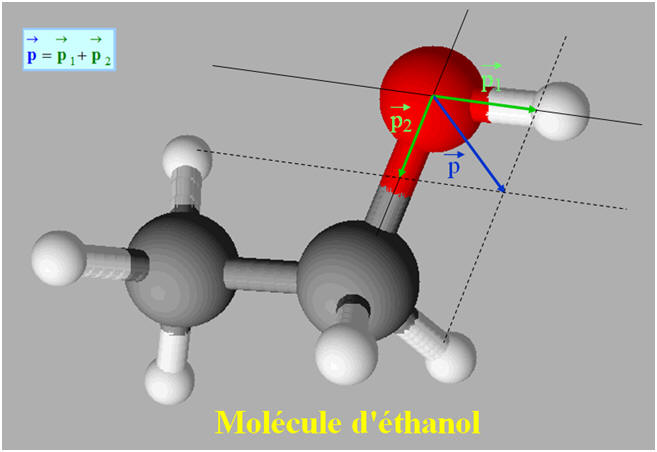
L’éthanol :
-
La molécule
d’éthanol CH3 – CH2 – OH
est une molécule polaire, c’est un solvant
polaire.
-
Les solutés polaires sont solubles dans les
solvants polaires.
-
L’éthanol est soluble dans l’eau.
►
L’hexane :
-
L’hexane est une molécule apolaire. C’est un
solvant apolaire.
-
Les solutés moléculaires apolaires ou peu
polaires sont généralement solubles dans les solvants apolaires.
-
L’hexane est insoluble dans les solvants
polaires comme l’eau.
►
Dissolution du chlorure de cuivre (II) dans
l’eau :
CuCl2
(s) →
Cu2+ (aq) +
2
Cl– (aq)
-
La solution contient deux fois plus d’ions
chlorure que d’ions cuivre (II).
►
Dissolution du nitrate de fer (III) dans
l’eau :
Fe(NO3)3
(s) →
Fe3+ (aq) +
3
NO3– (aq)
-
La solution contient trois fois plus d’ions
nitrate que d’ions fer (III).
-
Tableau d’avancement :
|
Équation bilan |
|
eau |
|
|
|
|
|
Fe(NO3)3
(s) |
→ |
Fe3+
(aq) |
+ |
3
NO3– (aq) |
||
|
État du système |
Avancement |
n (Fe(NO3)3) |
|
n (Fe3+) |
|
n (NO3–) |
|
État initial |
x
= 0 |
n (s) ≈ |
|
0 |
|
0 |
|
État final |
x = xmax |
n (s) – xmax
= 0 |
|
xmax
= n (s) |
|
xmax
= 3 n (s) |
-
Concentration en soluté apporté :
-
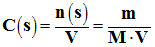
-
Masse de soluté nécessaire :
-
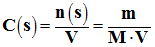
-
Concentration en ions nitrate :
-
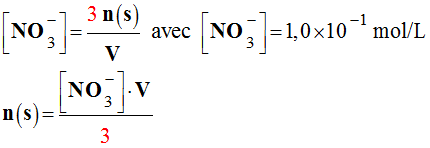
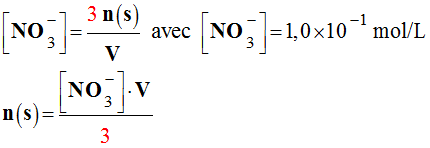
-
Masse de soluté nécessaire :
-
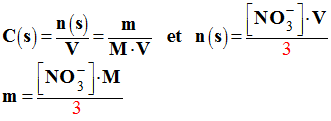
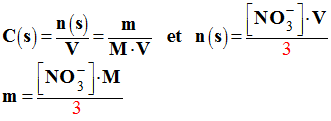
-
Application numérique :
-
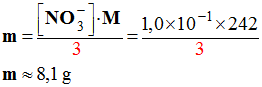
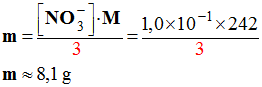
|
|