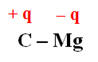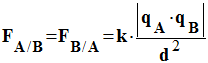|
QCM N° 09 a |
Cohésion des solides |
|
|
|
|
QCM N° 08 a :
Cohésion des solides.
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Lorsqu’un solide moléculaire reçoit de l’énergie par transfert thermique : |
sa température augmente
toujours. |
sa température peut rester
constante. |
l’agitation thermique de ses molécules augmente
forcément. |
BC |
|
2 |
La température de fusion du glucose est 186 ° C et celle du diiode est 113 ° C à 1013 hPa. Les interactions entre molécules de
diiode sont : |
plus fortes que les interactions entre molécules
de glucose. |
moins fortes que les interactions entre molécules
de glucose. |
aussi fortes que les interactions entre molécules
de glucose. |
B |
|
3 |
La valeur de la force électrostatique qui s’exerceentre 2 corps électriquement chargés distants de
d : |
varie dans le même sens que la valeur absolue du produit des
charges. |
augmente si
d augmente. |
augmente si
d diminue. |
AC |
|
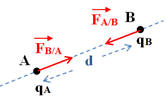
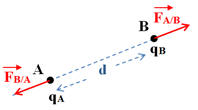
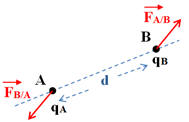
4 |
Le schéma correspondant au cas où qA et qB sont de signes contraires est : |
A |
|||
|
5 |
La cohésion du solide ionique NaCl est assuré par : |
les forces attractives qui s’exercent entre deux ions sodium Na+ ou entre deux ions
chlorure
Cl–. |
les forces attractives qui s’exercent entre les ions sodium Na+ et les ions
chlorure Cl–. |
des liaisons covalentes entre les atomes de sodium Na et les atomes
de
chlore Cl. |
B |
|
6 |
La
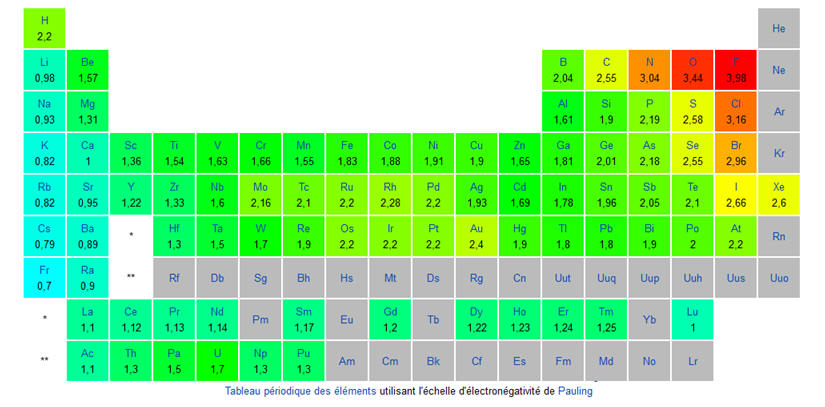
liaison : Données : électronégativités : χ (C) = 2,6 ; χ (Mg) = 1,3 ; χ (Cl) = 3,2 ; χ (O) = 3,4 ;
χ (H) =
2,2 |
carbone – chlore est ainsi
polarisée :
|
carbone – magnésium est ainsi
polarisée :
|
Cl – Cl n’est pas
polarisée. |
AC |
|
7 |
Le schéma d’une liaison hydrogène (représentée par --------) peut être :
|
|
|
|
B |
|
8 |
L’acide éthanoïque est formé de molécules de formule semi-développée suivante :
À l’état solide, sa cohésion est assurée : |
uniquement par des liaisons
hydrogène. |
uniquement par des liaisons de
Van der Waals. |
par des liaisons de Van der Waals et par des liaisons
hydrogène. |
C |
|
9 |
La cohésion du solide moléculaire I2 est assurée par des liaisons : |
hydrogène
uniquement. |
de Van der Waals et des liaisons
hydrogène. |
de Van der Waals
uniquement. |
C |
|
10 |
Un
cristal ionique : |
est constitué de cations
et d’anions. |
est seulement constitué de cations ou
d’anions |
est électriquement
neutre. |
AC |
►
Transfert thermique.
-
Lorsque l’on chauffe un solide, l’énergie
thermique apportée à un corps pur moléculaire peut :
-
Conduire à une élévation de la température
avec rupture d’interactions intermoléculaires et accroissement de
l’agitation des molécules
-
Provoquer un changement d’état avec seulement
rupture d’interaction intermoléculaires, la température restant constante.
-
Lorsque l’on chauffe un corps pur moléculaire
solide sa température peut rester constante.
►
Force électrostatique :
|
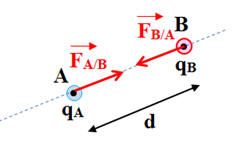
Énoncé ; Deux corps ponctuels A et B, de charges q A et q B, séparés par une distance d, exercent l’un sur l’autre des forces attractives ou répulsives telles que : -
- Caractéristiques des deux forces : -
La force
- La force
- Elles ont la même direction : la droite (AB). - Elles ont des sens opposés. - Elles sont attractives si les charges sont de signes opposés. - Elles sont répulsives si les charges sont de même signe. - Elles ont la même valeur : -
Expression :
|
-
Charles Augustin Coulomb : 1785.
- La constante k = 9,0 × 10 9 N . m 2 . C – 2.
- Au niveau de la
première, on écrit :
-
k = 9,0
× 10
9
S.I
-
En conséquence, la force qui s’exerce entre
deux charges électriques distantes de d est inversement
proportionnelle à d2.
►
Force électrostatique et charges
électriques :
-
Les forces sont répulsives si les charges
sont de mêmes signes
-
On considère que : qA . qB
> 0
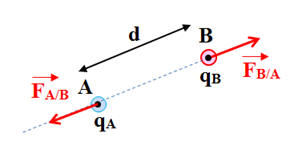
-
Les forces sont attractives si les charges
sont de signes contraires.
-
On considère que : qA . qB
< 0
►
Solide ionique :
-
Cohésion d’un cristal ionique :
-
Un solide ou cristal ionique est un
assemblage compact et ordonné d’anions et de cations assimilables à des
sphères dures.
-
Un solide ionique est électriquement neutre.
-
La cohésion du cristal ionique est due aux
forces d’interactions électriques :
-
Les forces d’attraction électriques entre les
ions de signes opposés l’emportent sur les forces de répulsion entre les
ions de même signe.
-
Dans l’écriture de la formule d’un solide
ionique, les charges ne figurent pas.
-
Par convention, on choisit les plus petits
indices qui assurent l’électroneutralité du cristal.
-
La formule statistique indique la nature et
la proportion des ions présents dans le cristal sans mentionner les charges.
►
Polarisation d’une liaison covalente :
-
Une liaison covalente est polarisée lorsque
les deux atomes liés ont des électronégativités différentes.
-
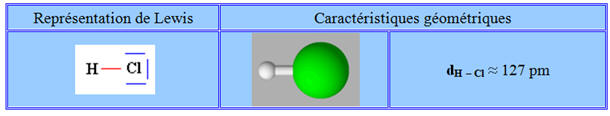
Exemple : La molécule de chlorure
d’hydrogène.
-
Le chlorure d’hydrogène est constitué de
molécules HCl dans lesquelles l’atome d’hydrogène est lié à l’atome
de chlore par une liaison covalente.
-
Le chlore est beaucoup plus électronégatif
que l’hydrogène.
-
Il attire vers lui le doublet de liaison : on
dit que la liaison H – Cl est polarisée.
-
Cette polarisation fait apparaître :
-
Un excédant de charge négative, noté – q,
sur l’atome de chlore (q
représente une charge partielle).
-
Un excédant de charge positive, noté + q,
sur l’atome d’hydrogène.
-
La molécule de chlorure d’hydrogène a un
caractère dipolaire : elle constitue un dipôle électrique.
-
Elle peut être représentée par un dipôle
portant les charges – q et + q
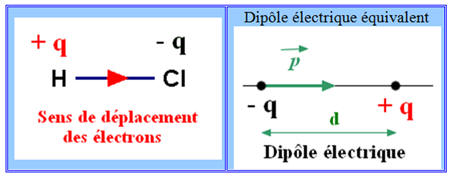
-
En conséquence : d’après les
électronégativités des atomes :
-
La liaison C – Cl est ainsi
polarisée :
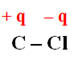
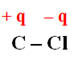
-
La liaison C – Mg est ainsi
polarisée :
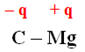
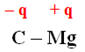
►
Liaison hydrogène :
|
- Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très
électronégatif et porteur d’un ou plusieurs doublets non liants. - Les atomes A et B qui interviennent généralement sont : - l’azote
N, l’oxygène
O, le
fluor F et le chlore
Cl.
-
Les trois atomes qui participent à la liaison hydrogène
sont généralement alignés.
|
-
Les molécules qui possèdent le groupe – O
– H forment des liaisons hydrogènes.
-
C’est le cas des alcools comme l’éthanol, de
l’eau dans la glace.
-
Ces liaisons hydrogènes participent à la
cohésion du cristal.
-
Dans ce cas, la cohésion du cristal est due
aux liaisons hydrogène et aux interactions de Van Der Waals.
-
Représentation de la liaison hydrogène :
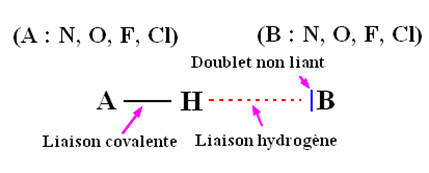
►
Acide éthanoïque :
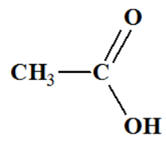 Ou
Ou
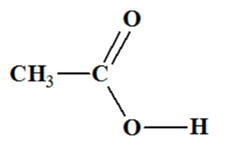
L
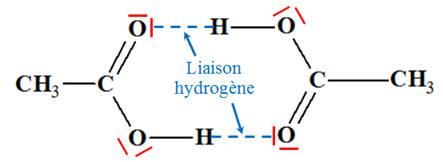
-
À l’état solide, la cohésion de l’acide
éthanoïque est assurée par des liaisons de Van der Waals et par des liaisons
hydrogène.
►
Les solides moléculaires.
-
Cohésion d’un cristal moléculaire :
-
Un cristal moléculaire est un assemblage
compact et ordonnée de molécules.
-
La cohésion des solides moléculaires est
assurée par deux types d’interactions moléculaires :
-
L’interaction de Van Der Waals,
-
Les liaisons hydrogène.
-
La cohésion des solides moléculaires est
nettement moins forte que la cohésion des solides ioniques.
-
L’interaction de Van Der Waals est moins
forte que l’interaction électrostatique.
-
Il suffit de comparer les températures de
fusion de solides ioniques et de solides moléculaires pour mettre en
évidence cette différence.
-
Exemple : La température de fusion de l’eau
est égale à 0 ° C alors que la température de fusion du chlorure de sodium
est égale à 801 ° C.
►
Le cristal ionique :
-
Un solide ou cristal ionique est un
assemblage compact et ordonné d’anions (ions négatifs) et de cations (ions
positifs) assimilables à des sphères dures.
-
Un solide ionique est électriquement neutre.
Il possède autant de charges positives que de charges négatives.
|
|