|
QCM N° 07 a |
Interactions fondamentales et réactions nucléaires. |
|
|
|
|
QCM N° 07 a :
Interactions fondamentales et réactions
nucléaires.
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La
charge de l’électron est : |
appelée la charge
élémentaire. |
nulle. |
égale à
–
e |
C |
|
2 |
La
masse d’un neutron est : |
du même ordre de grandeur que celle d’un
électron. |
négligeable par rapport à celle
d’un proton. |
du même ordre de grandeur que celle d’un
proton. |
C |
|
3 |
L’atome de représentation
|
est isotope de l’atome de représentation symbolique
|
est isotope de l’atome de représentation symbolique
|
contient
125 neutrons. |
AC |
|
4 |
La représentation symbolique d’un atome de silicium est
Il
contient : |
28 nucléons
et 14
électrons. |
28 nucléons
et 14
protons. |
28 neutrons
et 14
électrons. |
AB |
|
5 |
À
l’échelle de la molécule :
|
l’interaction gravitationnelle est
prédominante. |
l’interaction électromagnétique est
prédominante. |
l’interaction forte est
prédominante. |
B |
|
6 |
L’interaction forte prédomine : |
à l’échelle
astronomique. |
à l’échelle
humaine. |
à l’échelle du noyau
atomique. |
C |
|
7 |
L’interaction gravitationnelle : |
a une portée
limitée. |
est toujours
attractive. |
prédomine à l’échelle de
la Galaxie.
|
BC |
|
8 |
Un échantillon a une activité de 480 Bq. Le nombre de noyaux désintégrés en une minute est : |
8 |
2,88
× 104 |
1,73
× 106 |
B |
|
9 |
Les transformations nucléaires obéissent toujours aux lois
suivantes : |
conservation
de la masse. |
conservation du nombre de charge et du nombre
de masse. |
conservation du nombre de protons et du nombre
d’électrons. |
B |
|
10 |
Le
phosphore 30 ( radioactif β+ (la particule émise est un
positon
Le noyau fils est :
|
un noyau
|
un noyau
|
un noyau
|
A |
|
11 |
On s’intéresse à la réaction d’équation :
On
note
L’énergie libérée est donnée par la relation : |
|
|
|
B |
►
Structure des atomes :
-
Un atome est une entité constituée d’un noyau
et d’électrons en mouvement dans le vide autour du noyau.
-
Le noyau :
-
Le noyau est constitué de particules appelées
nucléons.
-
Les nucléons sont de deux types : les protons
et les neutrons.
-
Caractéristiques du proton :
-
Masse :
mp = 1,67265
× 10 – 27
kg
-
Charge : + e = 1,602189
× 10 – 19
C
-
C est le symbole du coulomb unité de
charge électrique
-
Caractéristiques du neutron :
-
Masse : mn
= 1,67496
× 10 – 27
kg
-
Charge : nulle
-
Remarque : e représente la
charge élémentaire (la plus petite charge connue).
-
Toute charge électrique Q s’exprime en
un nombre entier de charges élémentaires :
Q = n .
e
-
La masse du neutron est voisine de celle du
proton : mp ≈
mn
-
Caractéristiques de l’électron :
-
Masse
: me =
9,10953
× 10– 31
kg
-
Charge : - e = - 1,602189
× 10– 19 C
-
Mouvement des électrons autour du noyau :
- Les électrons d’un atome se déplacent à grande vitesse et à grande distance autour du noyau.
- Ils n’ont pas de trajectoire bien définie.
- C’est pour cela que l’on parle de nuage électronique.
- On peut délimiter une région de l’espace autour du noyau ou la
probabilité de trouver l’électron est maximale.
-
La masse du proton est environ 1846 fois
celle de l’électron.
|
Caractéristiques
du
proton |
Caractéristiques
du
neutron |
Caractéristiques
de
l’électron |
|
Masse :
mp =
1,67265
× 10 – 27
kg Charge : + e =
1,602189
× 10 –
19
C
|
Masse : mn
= 1,67496
× 10 – 27
kg Charge : nulle |
Masse :
me
= 9,10953
× 10– 31
kg
Charge : - e = -
1,602189
× 10– 19
C |
|
La masse d’un atome est
essentiellement concentrée sur son noyau
La masse du proton est
voisine de celle du neutron.
La masse du proton est
environ 1846 fois celle de l’électron.
La masse des électrons
est négligeable devant celle des nucléons. |
||
►
Masse de l’atome.
-
Atome le plus léger : atome d’hydrogène :
mH =
1,67
× 10 – 27
kg
-
L’un des plus lourd : atome d’uranium : mU =
3,95
× 10 – 25 kg
-
Il est environ 240 fois plus lourd.
-
La masse d’un atome est essentiellement
concentrée sur son noyau car la masse des électrons est négligeable devant
celle des nucléons :
-
mp
≈ 1846
me
-
La masse d’un atome de nombre de masse A :
mAtome ≈
A . mH
►
Écriture symbolique :
-
Les atomes sont représentés par des
symboles :
-
En général, la première lettre du nom écrite
en majuscule.
-
On rajoute parfois une deuxième lettre écrite
en minuscule pour éviter les confusions.
-
On trouve les symboles de tous les atomes
dans la classification périodique que l’on étudiera plus tard.
-
Le symbole du noyau s’obtient à partir du
symbole de l’atome correspondant.
-
Exemple : Symbole de l’atome d’hydrogène :
H, symbole du noyau :
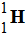
-
Nombre de protons : 1
Nombre de neutrons : 1
Nombre d’électrons : 1
- Formule
générage du noyau d'un atome :
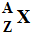
-
A : nom de masse, nombre de nucléons
-
Z : nombre de charges, nombre de
protons
-
A – Z : nombre de neutrons.
►
Les isotopes.
-
Des atomes sont isotopes si leurs noyaux
possèdent le même nombre de protons mais des nombres différents de neutrons.
►
Les interactions :
-
La force gravitationnelle.
|
Deux corps ponctuels A et B de masses respectives mA et mB exercent l’un sur l’autre des forces d’attraction, directement opposées, dirigées suivant la droite (AB), de valeur proportionnelle aux masses et inversement proportionnelle
au carré de leur distance
r. |
-
Schéma :
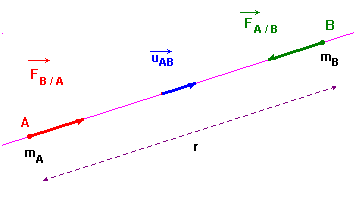
-
Expression vectorielle :
-


-
G est
la constante de gravitation
Universelle :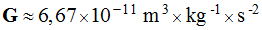 .
.
-
Interaction Gravitationnelle :
-
Cette interaction est toujours attractive.
-
Elle agit entre particules ayant une masse.
-
Sa portée est infinie, mais sa valeur diminue
quand la distance augmente.
-
À l’échelle Astronomique, elle est
prédominante devant les autres interactions.
-
Elle explique la cohésion des édifices
astronomiques.
-
La force électrostatique.
|
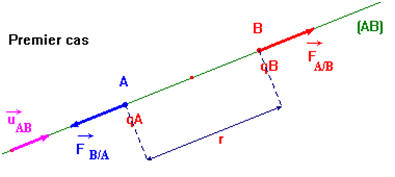
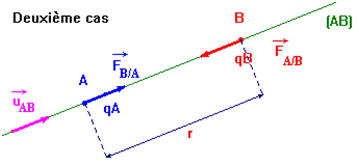
Dans le vide, deux particules A et B, portant les charges électriques respectives q A et q B, séparées par la distance r sont soumises à deux forces directement opposées : -
-
Expression :
|
-
Premier cas : on considère que : qA
. qB > 0
-
Deuxième cas : on considère que : qA
. qB < 0
-
Étude de l’expression :
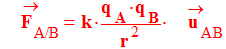
-
: vecteur
unitaire : direction droite
(AB)
et sens de A
vers B.
-
k :
constante


-
r :
distance séparant les deux charges électriques en mètre
m.
-
F :
force électrique en newton
N.
-
Interaction électromagnétique :
-
L’interaction électromagnétique peut être
répulsive ou attractive.
-
Elle agit entre particules portant une charge
électrique.
-
Sa portée est infinie, mais sa valeur diminue
quand la distance augmente.
-
Elle prédomine de l’échelle atomique et
à l’échelle humaine.
-
Elle explique la cohésion de l’atome.
-
L’interaction forte.
- Quelle est l’interaction qui assure la cohésion du noyau ?
- L’interaction électrique peut-elle expliquer la cohésion
du noyau d’un atome ?
-
Un noyau est constitué de protons et de
neutrons. Or les protons sont chargés positivement et se repoussent. Le
noyau devrait exploser.
-
À l’échelle nucléaire prédomine une autre
interaction fondamentale, appelée interaction forte.
-
Cette interaction attractive entre les
nucléons est 100 à 1000 fois plus grande que l’interaction électrique.
-
Son action est limitée à l’échelle du noyau :
elle est de l’ordre du femtomètre.
-
L’interaction forte est mise en jeu dans les
réactions nucléaires qui produisent de l’énergie dans les étoiles et les
centrales nucléaires.
-
L’énergie libérée par les réactions
nucléaires est nettement plus importantes que celle libérée par les
réactions chimiques.
-
Les Émissions Radioactives.
-
Une source radioactive peut émettre :
-
Des particules
-
Un rayonnement γ.
-
Les particules émises sont de trois types :
les particules α, β+et β–.
-
Les particules α (alpha).
-
Ce sont des particules positives, des noyaux d’hélium dont l’écriture
symbolique : 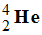 , ion
He2+.
, ion
He2+.
-
Les particules β (bêta).
-
On distingue :
-
Les
particules β– qui sont des électrons :
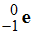
-
Masse : m
e = 9,1
× 10 – 31 kg
-
Charge :
- e = – 1,6
× 10 – 19 C.
-
Les
particules β+qui sont des positons (antiparticule de
l’électron) :
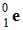
-
Masse : m
e = 9,1
× 10 – 31 kg
-
Charge :
e = 1,6
× 10 – 19 C.
►
La fission de noyaux lourds.
-
La réaction
de fission est une réaction nucléaire provoquée.
-
Au cours
d’une fission nucléaire, un neutron lent (neutron thermique) brise un noyau
lourd fissile en deux noyaux légers.
-
Cette
réaction libère de l’énergie.
►
La fusion de noyaux légers.
-
Au cours
d’une fusion nucléaire, deux noyaux légers s’unissent pour former un noyau
lourd.
-
C’est une
réaction nucléaire provoquée qui libère de l’énergie.
-
Des
particules et un rayonnement électromagnétique γ sont émis.
►
Les Lois de conservation : Loi de Soddy.
-
Toutes les
réactions nucléaires vérifient les lois de conservation suivantes :
-
Conservation
de la charge électrique.
-
Conservation
du nombre total de nucléons.
-
Conservation
de la quantité de mouvement.
-
Conservation
de l’énergie.
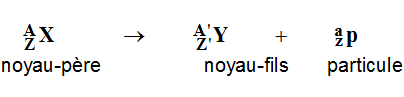
-
Lois de Soddy :
-
Conservation du nombre de nucléons : A =
A’ + a
-
Conservation de la charge globale : Z = Z’
+ z
►
Désintégration
β+ :
-
Le phosphore 30,
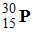 est radioactif β+ .
est radioactif β+ .
-
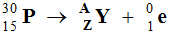
-
En utilisant les lois de Soddy :
-
A = 30 et Z = 14
-
Le noyau fils : 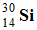 : Noyau de silicium 30.
: Noyau de silicium 30.
►
Activité d’un échantillon radioactif :
-
L’activité A d’un échantillon radioactif à la date t
est le nombre de désintégrations par seconde de cet échantillon.
-
1 Bq = 1 désintégration par seconde.
-
480 Bq = 480 × 60 désintégrations par minute.
►
Énergie libérée lors d’une réaction
nucléaire :
-
Une réaction nucléaire s’accompagne toujours
d’une diminution de la masse du système
-
Δm = mf – mi
< 0
-
Défaut de masse :
-
Lors d’une réaction nucléaire, la masse des
produits obtenus est inférieure à la masse des réactifs.
-
La masse manquante est appelée : perte de
masse : on la note |Δm|
-
Elle a pour expression :
-
|Δm| = |m (produits)
– m (réactifs)|
-
La perte de masse |Δm| s’exprime en
kilogramme (kg)
-
Énergie libérée :
-
Au cours de la réaction, le système cède de
l’énergie au milieu extérieur.
-
L’énergie libérée par le système a pour
expression :
-
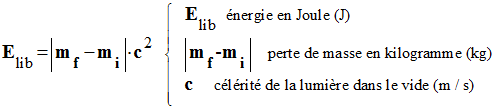
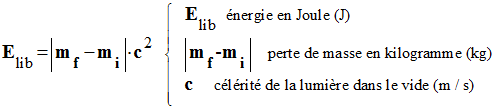
|
|
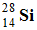 .
.