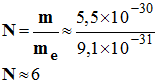|
Phys. N° 04 |
Cohésion de la matière. Exercices. |
|
|
Mots clés : cohésion de la matère, constituants de la matière, particules élémentaires, proton, neutron, électrons, quarks, atome, noyaux radioactifs, mercure, interactions fondamentales, interaction gravitationnelle, interaction électromagnétique, interaction forte, interaction faible, dimensions, échelle de grandeurs, infiniment grand, infiniment petit, loi de Coulomb, électrostatique, électromagnétisme, QCM, ... |
|
|
I- Exercice 7 page 128. Exprimer une charge.
|
En fonction de la charge élémentaire e : a)- Donner l’expression de la charge portée par un proton et celle portée par un électron. b)-
Donner l’expression de la charge d’un noyau
d’hélium de représentation symbolique
|
|
a)- Expression en fonction de la charge élémentaire : - Charge portée par un proton : provient d’un atome d’hydrogène ayant perdu 1 électron : + e. - Charge portée par un électron : – e b)- Expression de la charge du noyau d’hélium : - Z = 2, le noyau possède 2 protons : + 2 e. |
II- Exercice 8 page 128. Déterminer un numéro atomique.
|
La masse de tous les électrons d’un atome est m = 5,5 × 10– 30 kg. 1)- Combien d’électrons possède cet atome
sachant qu’un électron a une masse
me
= 9,1 ×
10– 31 kg. 2)- Quel est le nombre de charges positives portées par le noyau de cet atome ? Comment se nomment les particules qui portent ces charges positives. 3)- En déduire la valeur de son numéro atomique. |
|
1)- Nombre N d’électrons que possède ce noyau : - 2)- Nombre de charges positives de cet atome : - L’atome étant électriquement neutre, le nombre de charges positives est égal au nombre de charges négatives : - Le nombre de charges positives est égal à 6. - Les particules qui portent ces charges positives sont les protons. 3)- Cet atome possède 6 protons. Son numéro atomique est Z = 6 - C’est l’atome de carbone C. |
III- Exercice 9 page 128. Déterminer la composition d’un atome.
|
Le silicium est l’élément utilisé dans les panneaux photovoltaïques pour convertir la lumière en électricité. La charge
q du noyau de l’atome de silicium, de représentation
symbolique
q = 2,24 × 10– 18 C 1)- Combien de protons possède ce noyau, sachant
que la charge élémentaire vaut
e = 1,6 ×
10– 19 C. 2)- En déduire le nombre de neutrons de ce noyau. 3)- Quel est le nombre d’électrons de ce noyau ? |
|
1)- Nombre de protons que possède ce noyau : - La charge d’un noyau d’un atome est : - q = Z . e. - - Cet atome possède Z = 14 protons : 2)- Nombre de neutrons du noyau de cet atome : - N = A – Z = 28 – 14 - N = 14 3)- Nombre de neutrons de ce noyau : - L’atome est électriquement neutre : le nombre d’électrons est égal au nombre de protons. - Cet atome possède 14 électrons. |
IV- Exercice 12 page 128. Comparer des ordres de grandeur.
|
Le diamètre de notre galaxie, la Voie Lactée est d’environ 100000 années de lumière. Le Soleil a un diamètre de 1392000 km. 1)- Quel est l’ordre de grandeur du diamètre du Soleil ? 2)- Calculer, en km, l’ordre de grandeur du diamètre de notre galaxie. 3)- Comparer les ordres de grandeur de ces deux diamètres. Donnée : 1 a.l = 9,46 × 1015 m |
|
1)- Ordre de grandeur du diamètre du Soleil : D (S) ≈ 106 km 2)- Ordre de grandeur de notre galaxie : - D (g) ≈ 100000 × 9,46 × 1015 m avec 1 m = 10 – 3 km - D (g) ≈ 105
× 1016
× 10– 3
km - D (g) ≈ 1018
km 3)- Comparaison : -
- D (g) >> D (S) - Le diamètre de la galaxie est 1000 milliards de fois plus grand (1012) que celui du Soleil. |
V- Exercice 13 page 128. Connaître les interactions.
|
1)- Quelles sont les quatre interactions fondamentales ? 2)- Quelle interaction prédomine : a)- Entre deux protons d’un noyau ? b)- Entre le Soleil et la Terre ? |
|
1)- Les quatre interactions fondamentales : ► Les structures de l’Univers sont régies par quatre interactions fondamentales : - L’interaction gravitationnelle ; - L’interaction électromagnétique ; - L’interaction forte ; - L’interaction faible. 2)- Interaction qui prédomine : a)- Entre deux protons du noyau : - L’interaction forte assure la cohésion
du noyau atomique. - L’interaction forte est attractive. - Elle unit ensemble les nucléons et elle prédomine devant l’interaction électrique - (répulsion entre les protons). - C’est l’interaction forte qui prédomine
entre deux protons du noyau - L’interaction forte est intense mais de très courte portée (de l’ordre du femtomètre : - 10–15
m, soit un milliardième de micromètre). b)- Entre la Terre et le Soleil : - C’est l’interaction gravitationnelle qui prédomine à l’échelle du système solaire. - À l’échelle Astronomique, elle est
prédominante devant les autres interactions. - Elle explique la cohésion des édifices
astronomiques. - Elle explique le fait que la Terre tourne autour du Soleil. |
VI- Exercice 15 page 129. Autour du mercure.
|
À la température de 20 ° C, le mercure, de symbole Hg, est un métal gris et liquide. Le noyau de l’atome de mercure est caractérisé par des valeurs Z = 80 et A = 200. 1)- Comment appelle-t-on Z et A ? 2)- Donner la représentation symbolique de cet atome et indiquer sa composition. 3)- Calculer la valeur de la charge électrique q du noyau de cet atome. 4)- Calculer la valeur de la masse m de cet atome. - Données : - Masses du proton et du neutron : - mp = mn = 1,7 × 10– 27 kg - Masse de l’électron : - me = 9,1 × 10– 31 kg - Charge élémentaire : - e = 1,6 × 10– 19 C |
|
1)- A et Z : - La lettre A représente : le nombre de masse (le nombre de nucléons) - La lettre Z représente le nombre de charge - (le numéro atomique, le nombre de protons) 2)- Représentation symbolique de cet atome : - Symbole de l’élément : Hg -
Symbole du noyau de l’atome ou de l’atome :
- Composition de l’atome : - Il possède Z = 80 protons. - Il possède N = A – Z = 120 neutrons - Et E = Z = 80 électrons - (car un atome est électriquement neutre : - le nombre de protons Z est égal au nombre d’électrons E). 3)- Valeur de la charge électrique q du noyau de cet atome - q =
Z . e - q ≈ 80
× 1,6
× 10– 19
- q ≈ 1,3 × 10– 17 C 4)- Valeur de la masse de cet atome : - m ≈ A . mp ≈ A . mn - Car mp = mn = 1,7 x 10– 27 kg et me << mp = mn - m ≈ 200
× 1,7
× 10
– 27 - m ≈ 3,4 × 10– 25 kg |
VII- Exercice 18 page 129. Noyaux radioactifs.
|
« Les forces nucléaires agissent principalement entre chaque proton ou neutron et son plus proche voisin, tandis que les forces électrostatiques agissent sur de plus grandes distances, donnant une répulsion entre
chaque proton et tous les autres protons du noyau. Plus il y a de protons dans
le noyau, plus forte est la répulsion
électrostatique, plus le noyau est instable. » D’après Richard Feynman Dans la nature, on trouve de l’uranium 235 de nombre de masse 235 et de l’uranium 238 de nombre de masse 238. Ces noyaux, de numéro atomique Z = 92, sont radioactifs et émettent, en se désintégrant, une particule alpha (noyau d’hélium). 1)- Les noyaux : a)- Donner la composition des noyaux cités. b)- Comment nomme-t-on ce type de noyaux ? 2)- La particule alpha émise lors de la désintégration est un noyau d’hélium de nombre de masse A = 4. a)- Quel est le numéro atomique de l’hélium ? S’aider si nécessaire de la classification périodique. b)- Quelle est la composition de la particule alpha. 3)- Quel est l’effet de l’interaction électrostatique s’exerçant entre les protons d’un noyau ? 4)- En quoi l’émission d’une particule alpha peut-elle stabiliser un noyau comportant trop de nucléons ? |
|
1)- Les noyaux : a)-
Uranium 235 :
- Il possède Z = 92 protons et N = A – Z = 143 neutrons. - Uranium 238 :
- Il possède Z = 92 protons et N = A – Z = 146 neutrons. b)- Ce sont des noyaux isotopes : - L’uranium 235 et uranium 238 possèdent le même nombre de protons mais un nombre différent de neutrons. 2)- La particule alpha : a)- Numéro atomique de l’hélium : Z = 2 b)- Composition de la particule alpha : noyau d’hélium - - Il possède Z = 2 protons et N = A – Z = 2 neutrons. 3)- Effet de l’interaction électrostatique s’exerçant entre les protons d’un noyau : - Interaction électrostatique : deux charges de mêmes signes se repoussent. - Il y a répulsion entre les protons qui cherchent à s’éloigner l’un de l’autre ce qui va à l’encontre de la cohésion du noyau. 4)- Stabilisation d’un noyau comportant trop de nucléons : - L’émission d’une particule alpha fait diminuer le nombre de nucléons du noyau de la valeur 4. - Le noyau fils obtenu possède 2 protons et 2 neutrons de moins que le noyau père. - L’interaction électrostatique diminue donc et le noyau obtenu (noyau fils) possède une plus grande stabilité que le noyau initial (noyau père). |
VIII- Exercice 20 page 130. Interpréter l’expérience de Rutherford.
|
Au début du XXe siècle, E. Rutherford détermine la structure d’un atome en bombardant une feuille d’or par des noyaux d’hélium
Il observe que certaines de ces particules α sont déviées lorsqu’elles traversent la feuille d’or constituée d’atomes d’or
de représentation symbolique
1)- En fonction de la charge élémentaire e, exprimer : a)- La charge q1 du noyau d’un atome d’or ; b)- La charge q2 de la particule α. 2)- Interactions : a)- À quelles interactions le noyau d’un atome d’or et une particule α sont-ils soumis lorsqu’ils sont à proximité l’un de l’autre ? b)- À cette échelle, quelle est l’interaction prépondérante ? 3)- Quelle conclusion Rutherford a-t-il tiré de son observation ? |
|
1)- Les Charges : a)- Charge q1 portée par noyau d’atome d’or : - q1 = Z . e -
q1 ≈ 79
× 1,6
× 10– 19
- q1 ≈ 1,3 × 10– 17 C b)- Charge q2 de la particule α. - q2 = Z . e -
q2 ≈ 2
× 1,6
× 10– 19
- q2 ≈ 2,2 × 10– 19 C 2)- Les interactions : a)- Le noyau d’un atome d’or et une particule α sont soumis à - L’interaction électrostatique : - le noyau d’or est chargé positivement et la particule alpha est un noyau d’hélium chargé positivement. - Il y a répulsion entre ces deux particules. - L’interaction gravitationnelle : ces deux particules possèdent une masse. Il y a attraction gravitationnelle. b)- À l’échelle de l’atome, l’interaction électrique prédomine devant l’interaction gravitationnelle. 3)- Conclusion de Rutherford : - La matière est essentiellement faite de vide. - Les particules α sont déviées lorsqu’elles rencontrent le noyau des atomes d’or, - sinon, elles traversent l’atome sans être déviées. - Cette expérience nous renseigne sur la structure de l’atome. - Rutherford a élaboré le modèle de l’atome dans lequel, il y a un noyau central, - chargé positivement sur lequel est concentré presque la totalité de la masse de l’atome. - Ce noyau central est entouré d’électrons qui se déplacent à grande vitesse autour du noyau. |
|
|