|
QCM. N° 05 |
Quantités de matière |
|
|
|
|
|
Masse d’une
entité m, Nombre d’entités N . Quantité de matière n,
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La formule brute du trioxyde de soufre, dont le modèle est donnée ci-dessous,
est :
Données :
●
S
●
O |
S3O |
SO3 |
SO |
B |
|
2 |
Soit m (N) la masse d’un atome d’azote et m (O) lamasse d’un atome d’oxygène. La masse d’une molécule de protoxyde
d’azote N2O estégale à :
|
m (N) +
m (O) |
2 x m (N) +
m (O) |
m (N) +
2
x m
(O) |
B |
|
3 |
La relation entre la masse m d’un échantillon d’une espèce, le nombre N d’entitésqu’il contient et la masse mentité d’une
entité est : |
m
= N
x mentité |
|
|
AB |
|
4 |
Un échantillon d’une espèce est composé d’entités dont la masse est de l’ordre de
10–26
kg. L’ordre de grandeur de la masse de cet échantillon est 10 g.
Il contient de
l’ordre de : |
1027
entités |
1024
entités |
10–27
entités |
B |
|
5 |
Le bécher ci-dessous contient
1,0 mole
de cuivre.
Données :
m
(Cu) = 1,06
x 10–27
kg
m
(Al) = 4,51
x 10–26
kg |
Deux moles de cuivre ont une masse de
127 g. |
Une mole d’aluminium a aussi une masse
de 63,5 g |
Une mole d’aluminium a une masse inférieure à
63,5 g |
AC |
|
6 |
La quantité de matière
d’une espèce
chimique : |
a pour
symbole NA. |
S’exprime
en mole. |
a pour
symbole N. |
B |
|
7 |
La constante d’Avogadro
est égale à : |
6,02 × 1023
mol –1 |
6,02 × 10–23
mol –1 |
6,02 × 10–23
mol |
A |
nombre d'entités :
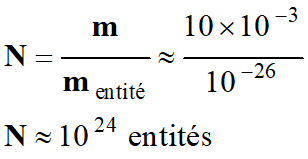
La mole :
Quantité de matière de l'espèce chimique considérée
A :
|
Température ° C |
Pression Pa |
Volume molaire
L.mol–1 |
|
|
O |
1,013
× 105 |
22,4 |
C.N.T.P |
|
20 |
1,013
× 105 |
24,0 |
|
|
20 |
10,13
× 105 |
2,40 |
|
Quantité de matière de l'espèce chimique gazeuse :