|
Structure des entités organiques |
|
|
|
|
|
|
QCM N° 07
Les familles
des composés organiques.
Le nom et la
formule semi-développée.
La
spectroscopie infrarouge.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La molécule de cholestérol, de formule brute C27H46O, possède :
|
27 atomes
de carbone. |
27 atomes
d’hydrogène. |
1 atome
d’oxygène. |
AC |
|
2 |
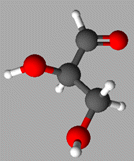
La molécule de glycéraldéhyde modélisée
ci-dessous :
|
A pour formule
C3H6O3.
|
A pour formule
semi-développée
|
A pour formule
semi-développée
|
ABC |
|
3 |
La molécule dont la formule
semi-développée est :
|
Est un acide
carboxylique |
possède un
groupe
hydroxyle |
Possède un
groupe
carbonyle |
A |
|
4 |
Le groupe
carbonyle est présent
dans la formule
semi-développée : |
|
|
|
AC |
|
5 |
La molécule
d’octanal : |
Est un
aldéhyde. |
Est un alcool. |
Possède
8
atomes
de carbone. |
AC |
|
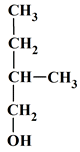
6 |
La molécule
de formule
semi-développée ci-dessous
se nomme :
|
2-méthylméthanal |
méthanal |
Éthanal |
C |
|
7 |
La formule semi-développée du 2-méthylbutan-1-ol est : |
|
|
|
A |
|
8 |
Dans un
spectre infrarouge, on lit
généralement |
La longueur
d’onde en
abscisse |
La
transmittance
en ordonnée |
Le nombre
d’onde en
abscisse. |
BC |
|
9 |
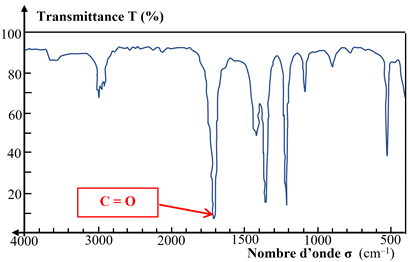
Le spectre IR ci-dessous est celui d’une espèce dont :
|
Les molécules
possèdent un
groupe
hydroxyde |
Les molécules
possèdent un
groupe
carbonyle |
Les molécules
possèdent un
groupe
carboxyle |
A |
|
10 |
La spectroscopie IR permet : |
D’identifier la présence de certains
types
de liaisons. |
D’identifier la nature
de
toutes
les liaisons
d’une molécule |
De connaître
le nombre
d’atomes de
carbone
présents
dans une
molécule. |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Modélisation des molécules :
|
Élément
chimique |
H |
O |
N |
Cl |
C |
S |
|
Couleur |
Blanc |
Rouge
|
Bleu |
Vert |
Noir |
Jaune |
|
Représentation |
|
|
|
|
|
|
La formule brute :
La formule développée plane.
Formule semi-développée.
Formule topologique.
Groupes caractéristiques :
|
Groupe caractéristique |
Famille
de composés |
Formule
générale |
|
–OH
Hydroxyle |
Alcool |
R – OH |
|
Carbonyle |
aldéhyde |
|
|
Cétone |
|
|
|
carboxyle |
Acide
carboxylique |
|
Les différentes structures de
l'atome de carbone.
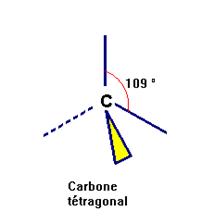

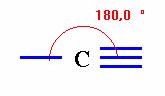
Ou
Composition d’une molécule organique.
Nomenclature en chimie organique :
préfixe
– racine –
suffixe
|
Famille de
composés |
alcool |
aldéhyde |
cétone |
acide
carboxylique |
|
Suffixe |
ol |
al |
one |
oïque |
|
Formule générale |
R – OH |
|
|
|
|
Groupe alkyle |
Nom |
|
–CH3 |
méthyl- |
|
–CH2–CH3 |
éthyl- |
|
–CH2–CH2–CH3 |
propyl- |
|
–CH2–CH2–CH2–CH3 |
butyl- |
La spectroscopie infrarouge :
|
Liaison |
σ
(cm–1) |
Bande |
|
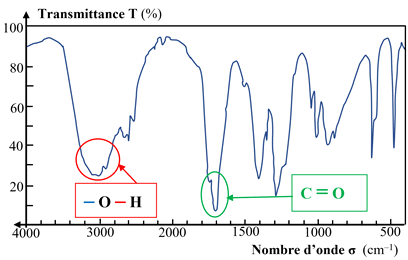
–O – H
Alcool |
3200 – 3400 |
Bande forte et
large |
|
–O – H
Acide
carboxylique |
2600 – 3200 |
Bande forte et
large |
|
C = O
Aldéhyde
Cétone
Acide
carboxylique |
1700 – 1760 |
Bande forte et
fine |
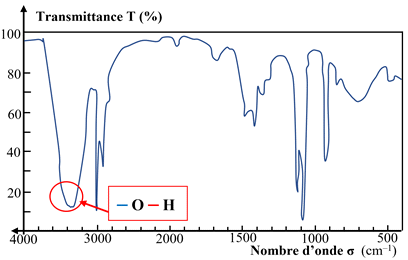
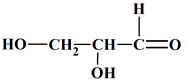
ou
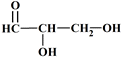
ou
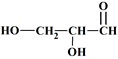
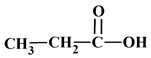
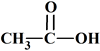
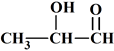
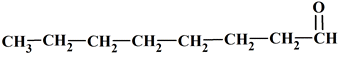
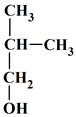
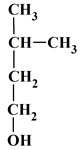
|
|