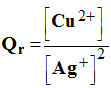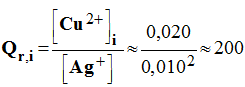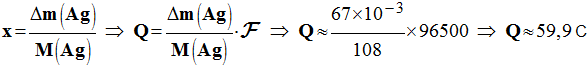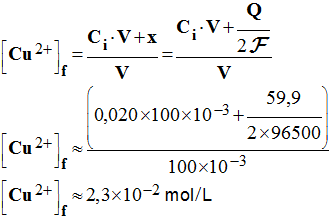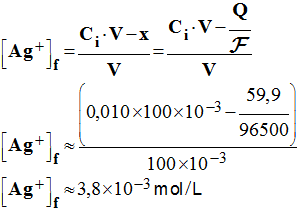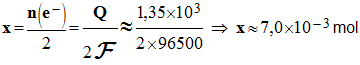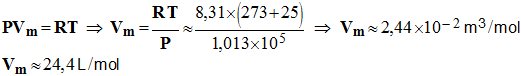|
Pile ; Electrolyse Partie A : Étude d’une pile argent / cuivre Partie B : |
Correction |
|
|
|
Pile ;
électrolyse
Partie A :
Étude d’une pile argent / cuivre
|
On s’intéresse à une pile constituée d’une demi-pile
Ag + /
Ag
et
d’une demi-pile
Cu 2+ /
Cu reliées par un pont
salin.
La constante d’équilibre associée à la réaction :
2 Ag
+
(aq)
+
Cu (s)
=
2
Ag (s) +
Cu 2+
(aq) est
K = 2 x 10 15.
Les concentrations des ions métalliques sont [Ag
+] = 0,010 mol / L et
[Cu
2+] = 0,020 mol / L.
Les solutions utilisées ont chacune un volume
V =
1°) Déterminer le quotient de réaction dans l’état initial.
En déduire
le sens d’évolution spontané de la réaction qui se produit dans la pile. - Expression du quotient de réaction de la réaction :
-
- Quotient de réaction à l’état initial :
- - Évolution spontanée de la réaction : Q r,i < K la réaction évolue dans le sens direct de l’écriture de l’équation de la réaction (formation d’argent métallique et d’ions cuivre II et disparition de cuivre métal et d’ions argent I). 2°) Établir les équations des réactions se produisant aux électrodes puis l’équation de la transformation ayant lieu dans la pile.
Nommer les
électrodes et donner la polarité de chaque électrode. - Réactions aux électrodes :
- Équation de la transformation ayant lieu dans la pile :
- Polarité de la pile : l’électrode d’argent constitue la borne positive de la pile et l’électrode de cuivre constitue la borne négative de la pile.
3°) Donner son schéma conventionnel.
- Schéma
conventionnel :
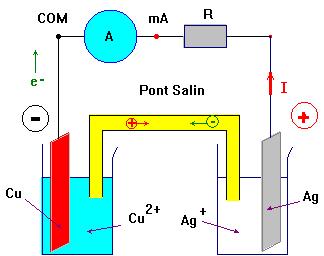
4°) Faire un schéma de la pile et y représenter le mouvement des
différents porteurs de charges. - Schéma de la pile :
5°) Comment varient les concentrations en ions métalliques dans chaque demi-pile ?
Comment est assurée l’électroneutralité de chaque solution
au cours du fonctionnement de la pile ? - La concentration des ions argent diminue au cours du temps (ils disparaissent) et la concentration en ions cuivre II augmente au cours du temps (ils se forment). - La neutralité des solutions est assurée par le déplacement des ions positifs et négatifs qui se déplacent en sens inverse. - Exemple : les ions positifs présents dans le pont salin se déplacent vers le récipient contenant la solution aqueuse d’ions argent et les ions négatifs présents dans le pont salin se déplacent vers le récipient contenant la solution aqueuse d’ions cuivre II.
6°) Pour une durée de
fonctionnement t, la
variation de masse de l’électrode d’argent Δm (Ag)
= 67 mg. Déterminer la quantité d’électricité
Q mise en jeu ? - Quantité d’électricité mise en jeu : - Q = n (e– ) . F - Il faut travailler avec une demi-équation électronique.
- En
conséquence : n (e
– ) =
x et
-
7°) Déterminer la variation de masse de l’électrode de cuivre. - Variation de masse de l’électrode de cuivre :
- En conséquence : n (e – ) = 2 x.
-
8°) Quelles sont les concentrations en ions métalliques après cette
durée de fonctionnement t ? - Concentrations en ions métalliques : - Lorsque la pile débile, la concentration en ions cuivre II augmente. - Au bout de la durée Δt, elle a augmenté de x, avec n (e – ) = 2 x et le volume de la solution n’a pas varié.
- - Lorsque la pile débile, la concentration en ions cuivre II diminue. - Au bout de la durée Δt, elle a diminué de x et le volume de la solution n’a pas varié.
-
On donne : M (Ag)
=
1
F
= 96500 C / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Partie B :
Électrolyse
d’une solution d’acide iodhydrique
|
On réalise l’électrolyse d’une solution aqueuse d’acide iodhydrique (H
+aq+ I
– aq), entre des électrodes inattaquables de platine, à Pour cela, on utilise un volume V = 500 mL d’une solution de concentration C = 0,10 mol / L. On observe la formation de diiode I2 en solution à l’anode et un dégagement de gaz à la cathode. Le gaz formé « aboie » en présence d’une flamme.
L’expérimentateur effectue l’électrolyse de la solution pendant une
durée t = 45 min, sous un
courant d’intensité I =
1°) Écrire les équations des réactions se produisant aux électrodes,
en
déduire l’équation de la réaction d’électrolyse. - équations des réactions se produisant aux électrodes : - À l’anode, il se produit une oxydation : - 2 I – (aq) = (aq) = I2 (aq) + 2 e – - c’est l’électrode reliée à la borne positive du générateur. - À la cathode, il se produit une réduction : - le gaz est du dihydrogène. - On peut donner l’équation simplifiée : - 2 H + (aq) + 2 e – = H 2 (g) - équation de la réaction d’électrolyse : 2 I – (aq) + 2 H + (aq) = I 2 (aq) + H 2 (g)
2°) Calculer la quantité d’électricité
Q qui a traversé
l’électrolyseur,
en déduire la quantité de matière en électrons
échangés. - quantité d’électricité Q qui a traversé l’électrolyseur :
-
- Quantité de matière en électrons échangés.
-
3°) Établir la relation liant Q
et la quantité de matière en protons ayant réagi. - relation liant Q et la quantité de matière en protons ayant réagi : - Q = n (e–) . F
- Q = n (H +) . F 4°) Déterminer le volume de gaz formé à la cathode.
-
La pression dans les
conditions de cette expérience est
P = 1,013 x 10 5
Pa. - Quantité de matière de gaz formé à la cathode :
- - Volume molaire :
- Volume du gaz :
- | ||||||||||||||||||||||||