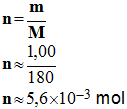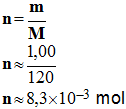|
|
Données :
|
Masses molaires atomiques : M (C) = 12,0 g / mol ; M (H) = 1,00 g / mol ; M (O) = 16,0 g / mol ; M (N) = 14,0 g / mol ; M (S) = 32,1 g / mol ; M (Mg) = 24,3 g / mol ;
M (Cl) =
35,5 g / mol Volume molaire : Dans les conditions normales de température
et
de pression (C.N.T.P) :
Vm
= 22,4 L / mol. |
I- Masses molaires, quantités de matière et nombre de moles.
|
1)- Dans le sang, on trouve différentes substances.
En particulier, lors d’une analyse de
sang, on recherche
le glucose
C6H12O6
et l’urée
C6H4N2O. a)- Calculer les masses molaires de ces molécules.
- Masse molaire de la molécule de glucose :
- M
(C6H12O6) = 6
M (C)
+ 12 M (H) + 6
M (O)
- M
(C6H12O6)
≈
6
x
12,0 + 12
x 1,00 + 6
x 16,0
-
M
(C6H12O6)
≈
180 g / mol
- Masse molaire de la molécule d’urée :
- M
(C6H4N2O) = 6
M (C)
+ 4 M (H) + 2
M (N) +
M (O)
-
M
(C6H4N2O)
≈
6
x
12,0 + 4
x 1,00 + 2
x 14,0+ 1
x 16,0
-
M
(C6H4N2O)
≈
120 g / mol
b)- Calculer la quantité de matière contenue dans une masse
m = 1,00
g de chacune de ces substances.
- Quantité de matière de glucose :
-
- Quantité de matière d’urée :
-
2)- Le sulfate d’ammonium {(NH4)2SO4}
est un composé présent
dans les engrais.
a)- Déterminer le nombre de moles d’atomes de chaque élément présent dans
une mole de sulfate d’ammonium. - Une mole de sulfate d’ammonium contient : - 2 moles d’atomes d’azote, - 8 moles d’atomes d’hydrogène, - 1 mole d’atome de soufre et
- 4 moles d’atomes
d’oxygène.
b)-
Déterminer la valeur de la masse molaire de ce composé. - Masse molaire du sulfate d’ammonium :
- M [(NH4)2
SO4]
≈ 132 g / mol
3)- On remplit un flacon de volume
V = 2,00 L de gaz dichlore
Cl2
dans les
C.N.T.P.
a)- Calculer la quantité de matière n
(Cl2) de dichlore
contenu dans le flacon.
- Quantité de matière de dichlore contenu dans le flacon :
-
b)-
Calculer la masse
m (Cl2)
de dichlore présent dans le flacon.
- Masse de dichlore présent dans le flacon : - m (Cl2) = n (Cl2) . M (Cl2) - m (Cl2) ≈ 8,93 x 10 – 2 x 2 x 35,5 - m (Cl2) ≈ 6,34 g 4)- L’acide sulfurique est une substance moléculaire de formule H2SO4.
Dans les C.N.T.P, c’est un liquide incolore, huileux de masse
volumique μ ≈
1,83 g / cm3.
a)- Calculer la masse molaire de l’acide sulfurique. - Masse molaire de l’acide sulfurique : - M (H2SO4) ≈ 98,0 g / mol b)- Calculer la quantité de matière d’acide sulfurique prélevée avec une pipette jaugée de 5 mL. - Masse d’acide sulfurique prélevée : - m = μ .V - m ≈ 1,83 x 5,00 - m ≈ 9,15 g - Quantité de matière correspondante :
- |
II- Solution aqueuse et concentration.
|
1)- On pèse une
masse m1
= 27,0 g de glucose C6H12O6 dans le but de
fabriquer un volume
V1 = 100,0 mL
d’une solution aqueuse
S1 de glucose. a)- Calculer la quantité de matière n1 de glucose utilisé. - Quantité de matière de glucose utilisé :
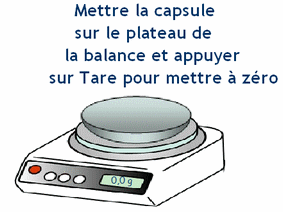
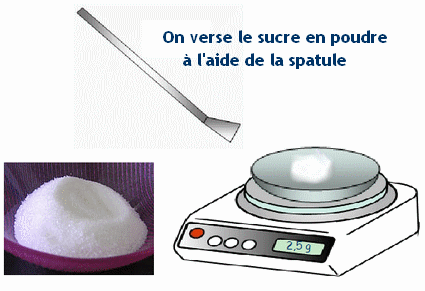
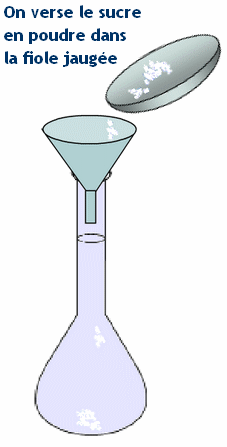
- b)- Indiquer le matériel utilisé pour préparer cette solution. - Matériel : - Coupelle, balance, entonnoir, - fiole jaugée de 100 ,0 mL, - pipette simple pour ajuster le volume d’eau, - pissette d’eau distillée. c)- Donner le mode opératoire (On peut faire des schémas). - Mode opératoire : - On pèse la masse m de soluté au moyen d’une balance. - On place le soluté dans un récipient et on utilise la fonction tare de la balance pour lire directement la masse du contenu du récipient. - On introduit le solide dans une fiole jaugée de volume V1 = 100 mL en utilisant un entonnoir. - On rince le récipient utilisé et l’entonnoir avec une pissette d’eau distillée. - L’eau de rinçage doit couler dans la fiole jaugée. - On remplit la fiole jaugée environ aux trois quarts avec de l’eau distillée et on agite pour accélérer la dissolution et homogénéiser la solution. - On complète avec de l’eau distillée jusqu’au trait de jauge. - On ajuste le niveau avec une pipette simple. - On bouche et on agite pour homogénéiser. - Schémas : |
Protocole


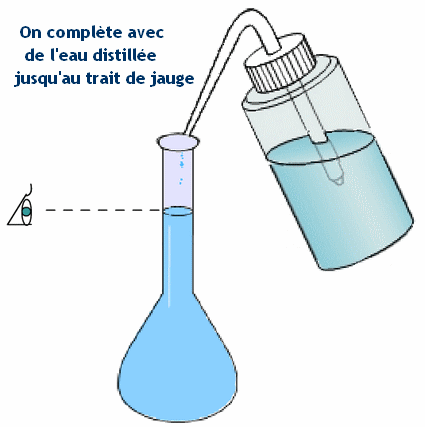
|
d)- Calculer la concentration C1 de la solution S1. - Concentration de la solution de glucose :
- e)- Comment appelle-t-on l’opération réalisée pour préparer la solution S1 ? - Nom de l’opération réalisée : - L’opération réalisée est une dissolution.
2)- On veut
préparer un volume
V2
= 200,0 mL d’une solution
S2
à partir de la solution
S1 telle que :
a)- Quel volume V de solution S1 doit-on utiliser ? Justifier la réponse. - Volume de S1 nécessaire :
- La quantité de matière n1 de glucose est la même dans la solution mère et dans la solution fille. - Il y a conservation de la quantité de matière de soluté : - la quantité de matière de soluté présente dans la solution mère : - n1 = C1.V (1) - la quantité de matière de soluté présente dans la solution fille : - n2 = C2.V2 (2) - Conséquence :
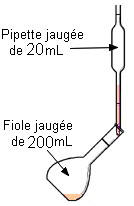
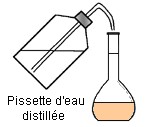
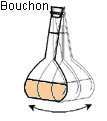
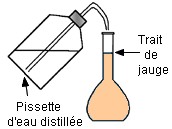
- b)- Indiquer le matériel utilisé et le mode opératoire. - Matériel : - Bécher, pipette jaugée de 20,0 mL, fiole jaugée de 200,0 mL, - pissette d’eau distillée, pipette simple. - Mode opératoire : - On verse un peu de solution mère dans un bécher - (on ne pipette jamais dans le récipient qui contient la solution mère). - On prélève le volume V = 20 mL à l’aide d’une pipette jaugée munie de sa propipette. - On verse le volume V = 20 mL dans une fiole jaugée de 200 mL. - On remplit la fiole jaugée environ aux trois quarts avec de l’eau distillée. - On mélange. - On complète avec de l’eau distillée jusqu’au trait de jauge. - On ajuste le niveau avec une pipette simple. - On bouche et on agite pour homogénéiser. |
|
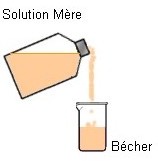
Verser suffisamment de solution Mère dans un bécher |
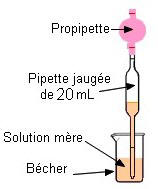
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié.. |
|
On ne pipette jamais directement dans le flacon qui contient
la solution Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite. Mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
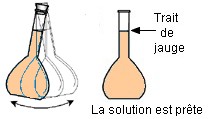
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
|
c)- Comment appelle-t-on l’opération réalisée pour préparer la solution S2 ? - Nom de l’opération réalisée : - On a effectué une dilution. |