|
Phys. N° 08 |
L'état Gazeux. Cours. |
|
|
Programme 2010 : La Pression Programme 2010 : Physique et Chimie Programme 2018 : Physique et chimie |
|
|
| Exercices (énoncé et correction) | |
|
Exercices 2005-2006 Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
|
1)- Exercice 3 page 162. 2)- Exercice 4 page 162. 3)- Exercice 10 page 163. |
4)- Exercice 12 page 163. 5)- Exercice 18 page 165. 6)- Exercice 19 page 165. |
|
Physique et Chimie seconde Collection Microméga Hatier Ancienne édition |
|
| Exercice 11 page 286 | Exercice 13 page 286 |
| Exercice 19 page 287 | Exercice 26 page 288 |
Pour aller plus loin :
|
Mots clés : l'état gazeux ; propriétés des gaz ; la pression ; la pression atmosphérique ; Torricelli ; la température ; la température absolue ; Gabriel Fahrenheit ; Celsius ; théorie cinétique des gaz ; ... |
- Verre que l’on retourne et que l’on plonge dans un cristallisoir.
- Le verre contient de la matière, c’est l’air qui nous entoure.
- Le verre n’est pas vide.
- L’air occupe tout le volume offert, il occupe tout le volume du verre.
- L’air est compressible. Le volume de l’air diminue lorsque la profondeur augmente.
- Les gaz se mélangent.
- Les particules qui constituent un gaz sont en mouvement.
- Ce mouvement ne peut pas être expliqué par l’effet de pesanteur.
|
Première étape : le récipient A contient du dioxyde d’azote (vapeurs rousses) et le récipient B contient de l’air (gaz incolore). Les deux récipients sont séparés par une feuille de papier. |
Deuxième étape : On enlève la feuille de papier, les deux gaz se mélangent. |
|
|
|
II-
Description d’un gaz. Description microscopique d’un gaz.![]()
- Les gaz ont une structure moléculaire : ils sont constitués de molécules très petites et très éloignées les unes des autres.
- Ces molécules se déplacent à très grande vitesse dans toutes les directions.
- Leur mouvement est rectiligne en l’absence d’obstacle.
- à l’état gazeux règne le chaos moléculaire.
- Des chocs peuvent se produire soit sur d’autres molécules du gaz, soit sur les parois du récipient qui le contient.
- Le gaz occupe tout le volume offert : il est expansif.
- Un ballon de baudruche que l’on gonfle, une seringue remplie d’air que l’on comprime.
- Le gaz enfermé dans un ballon de baudruche tend à repousser l’enveloppe élastique, à la distendre : l’enveloppe est soumise à des forces.
- Lorsque l’on pousse le piston de la seringue, on sent une opposition, une réaction à l’action exercée.
- Un gaz exerce des forces pressantes, réparties sur la surface des objets avec lesquels il est en contact.
- Un gaz exerce une force pressante sur les parois du récipient qui le contient.
- Un gaz exerce sur une petite portion de paroi une force pressante perpendiculaire à la surface et dirigée du gaz vers la paroi.
- Par définition, la pression d’un gaz est donnée par la relation suivante :
|
► F : Force pressante en newton (N)
►
S
: Aire de la surface pressée (m
2 ► p : Pression en pascal (Pa) |
- Par définition, l’unité légale de pression est le pascal de symbole Pa.
- C’est la pression exercée par une force pressante de 1 N sur une surface plane de 1 m2.
- On emploie couramment d’autres unités :
- Le bar (bar) : 1 bar = 10 5 Pa
- L’hectopascal : 1 hPa = 10 2 Pa = 1 mbar
5)- La pression atmosphérique.
- L’atmosphère terrestre est constituée d’un mélange gazeux : l’air qui est formé essentiellement de dioxygène et de diazote.
- La pression de l’air qui nous entoure s’appelle la pression atmosphérique.
- Cette pression est voisine de 1 bar au niveau du sol, soit en météorologie 1000 hPa.
- La valeur de la pression atmosphérique normale est de :
- 1013 hPa ; 1 atmosphère (atm) ; 760 mm de Hg ; 1,013 x 105 Pa ; 1,013 bar
- La pression atmosphérique diminue avec l’altitude.
6)- Mesure de la pression d’un gaz.
a)- Le manomètre.
- Les manomètres utilisent comme principe de fonctionnement :
- La déformation d’une paroi métallique ;


- La hauteur d’une colonne de liquide ;
- La variation de résistance électrique d’un cristal piézo-électrique.
- Les manomètres absolus : ils donnent la pression d’un gaz par rapport au vide.
- Les manomètres relatifs : ils donnent la différence entre la pression du gaz et la pression atmosphérique.
b)- Les Baromètres :
- Ils mesurent la pression atmosphérique : ce sont des manomètres absolus.
- Suivant les jours, la pression de l’air varie.
- Lorsqu’il fait beau temps la pression est haute (régime anticyclonique) et lorsqu’il pleut la pression diminue (dépression).
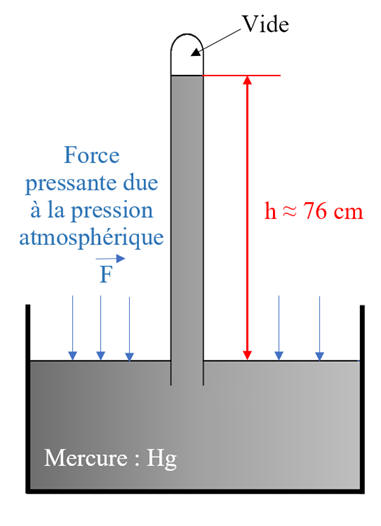
- Tube de Torricelli.
|
|
La valeur de la pression
atmosphérique peut se mesurer avec le baromètre de TORRICELLI. Un tube, plein de mercure (Hg), est fermé à une extrémité. On le retourne dans un bac contenant du Hg. La
force exercée sur la surface libre dans le bac par
la pression atmosphérique empêche le tube de se vider et laisse dans le tube une colonne de mercure de
Cette
colonne de |
- L’agitation des molécules d’un gaz dépend de la température : plus les molécules sont agitées et plus leur vitesse est grande et plus la température est élevée.
- La température d’un corps à l’état solide, liquide ou gazeux est liée à l’agitation des particules qui le constituent.
- La température est un indicateur de l’état thermique d’un corps.
- L’agitation des molécules est liée à la température du gaz : on l’appelle agitation thermique.
- Pour augmenter la vitesse des molécules, c’est-à-dire l’agitation, il faut chauffer le gaz.
- L’agitation thermique est utilisée pour définir la température d’un gaz.
2)- Phénomènes dépendant de la température.
a)- La dilatation : lorsqu’on chauffe un gaz, un liquide ou un solide, son volume augmente.
- C’est le phénomène de dilatation.
- On utilise ce phénomène pour fabriquer des thermomètres.
b)- La conduction électrique : la résistance électrique de certains conducteurs ou semi-conducteurs dépend de la température.
- Exemple : la diode, la CTN.
c)- Émission d’un rayonnement :
- Le spectre de la lumière émise par certains objets donne des indications sur la température de surface de ces objets.

Cliquer sur l'image pour l'agrandir
- Un thermomètre mesure la température d’un corps.
- Il comporte un capteur utilisant l’un des phénomènes précédents (dilatation, variation de la résistance d’un composant, étude du rayonnement).
- Ils sont gradués en degré Celsius (° C).
- Pour faire une bonne mesure, la sonde du thermomètre doit être en contact avec le corps.
- Il faut attendre que l’équilibre thermique soit établi entre le corps et la sonde du thermomètre.
- Le thermomètre à dilatation de liquide :
- C’est Gabriel Fahrenheit (1686-1736) qui a mis au point le premier thermomètre à mercure.
- On utilise, de nos jours, des thermomètre à alcool coloré ou un liquide à base de toluène.
- Le thermomètre électronique :
- il comporte une sonde de température associée à un système électronique qui permet d’afficher directement la température du corps.
- Le thermomètre à rayonnement infrarouge :
- Ce système est utilisé dans les nouveaux thermomètres médicaux.
- L’introduction de la sonde dans l’oreille permet de mesurer la température du corps.
- Le tympan de l’oreille partage une artère avec l’hypothalamus, centre du cerveau, qui contrôle la température du corps.
| Exercices (énoncé et correction) | |
|
Exercices 2005-2006 Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
|
1)- Exercice 3 page 162. 2)- Exercice 4 page 162. 3)- Exercice 10 page 163. |
4)- Exercice 12 page 163. 5)- Exercice 18 page 165. 6)- Exercice 19 page 165. |
|
Physique et Chimie seconde Collection Microméga Hatier Ancienne édition |
|
| Exercice 11 page 286 | Exercice 13 page 286 |
| Exercice 19 page 287 | Exercice 26 page 288 |