|
Réactions acido-basiques. Correction |
|
|
|
|
Objectifs : |
- Mettre
en évidence une réaction acido-basique.
-
Introduire
la notion de couple acide / base. |
I- Passage réciproque de l’acide à la base dans le cas des indicateurs colorés.
1)- Réalisation des transformations chimiques.
- Le bleu de bromothymol (B.B.T) est un colorant organique qui peut se présenter,
en solution aqueuse sous deux formes de couleurs différentes.
- Lorsque la solution est jaune, le B.B.T est sous sa forme acide notée H In (aq).
- Lorsque la solution est bleue, le B.B.T est sous sa forme basique notée In – (aq).
a)- Expérience 1 :
![]() Mode
opératoire :
Mode
opératoire :
- Dans un tube à essais, introduire quelques mL de solution de B.B.T de forme basique bleue.
- On donne à la solution la formule suivante : Na + (aq). + In – (aq).
- Ajouter une solution d’acide éthanoïque de formule CH3COOH (aq) à l’aide d’un compte-gouttes.
- Observer l’évolution de la couleur de la solution obtenue au cours de l’ajout.
![]() Faire des schémas légendés des différentes situations.
Faire des schémas légendés des différentes situations.
|
- Au fur et à mesure que l’on ajoute la solution d’acide éthanoïque (incolore), - Le mélange réactionnel change de couleur. - Lorsque la solution est jaune, le B.B.T est sous sa forme acide notée H In (aq). - Au cours de la réaction, il se forme la molécule H In (aq). |
- Quelle espèce chimique formée au cours de la transformation chimique peut-on identifier ?
- Recopier et compléter l’équation chimique suivante :
In – (aq) + CH3COOH (aq) → ……..……. + ……….….
|
- On ajoute de l’acide acétique, la solution passe du bleu au vert,
-
puis au jaune
(forme acide du B.B.T). - En conséquence, au cours de la réaction,
-
il se forme l’espèce chimique
H In (aq). - L’ion Na+ (aq) est spectateur, il ne participe pas à la réaction,
-
il assure la
neutralité électrique de la solution.
- Équation de la réaction :
In– (aq) + CH3COOH
(aq) → HIn
(aq) + CH3COO–
(aq)
|
b)- Expérience 2 :
![]() Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme acide jaune.
Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme acide jaune.
- Ajouter une solution d’ammoniac de formule NH3 (aq) à l’aide d’un compte-gouttes.
- Observer l’évolution de la couleur de la solution obtenue au cours de l’ajout.
![]() Faire des schémas légendés des différentes situations.
Faire des schémas légendés des différentes situations.
|
- Au fur et à mesure que l’on ajoute la solution d’ammoniac (incolore), - le mélange réactionnel change de couleur. - Lorsque la solution est bleue, - le B.B.T est sous sa forme basique notée In– (aq). - Au cours de la réaction, il se forme l’ion In– (aq). |
- Quelle espèce chimique formée au cours de la transformation chimique peut-on identifier ?
- Recopier et compléter l’équation chimique suivante :
H In (aq) + NH3 (aq) → ……..……. + ……….….
|
- la solution passe du jaune au vert,
-
puis au
bleu (forme basique du B.B.T). - En conséquence, au cours de la réaction,
-
il se forme l’espèce chimique
In
– (aq). - Équation de la réaction : H In (aq) + NH3 (aq) → In– (aq) + NH4+ (aq) |
2)- Notion d’acide et de base selon Bronsted.
a)- Interprétation de l’expérience 1 :
- Au cours de la transformation chimique qui a lieu lors de l’expérience 1 (reproduire le tableau et cocher les bonnes cases) :
|
L’ion In– |
La molécule CH3COOH |
||
|
□
a gagné |
□ un atome d’hydrogène |
□
a gagné |
□ un atome d’hydrogène |
|
□ un proton H+ |
□ un proton H+ |
||
|
□ a perdu |
□ a perdu |
||
|
□
un anion
H– |
□
un anion
H– |
||
|
L’ion
In– |
La molécule CH3COOH |
||
|
x
a gagné |
□
un atome d’hydrogène |
□
a gagné |
□
un atome d’hydrogène |
|
x
un proton
H+ |
x
un proton
H+ |
||
|
□ a perdu |
x a perdu |
||
|
□
un anion
H– |
□
un anion
H– |
||
b)- Conclusions et définitions :
|
- La molécule CH3COOH a perdu un proton H+ - pour donner l’espèce chimique CH3COO– (ion acétate ou éthanoate) :
-
La molécule
CH3COOH
est un acide au sens de Bronsted. - L’ion In– a gagné un proton H+ pour donner l’espèce chimique HIn :
-
L’ion
In– est une base selon
Bronsted. - Définitions :
- Un acide est une espèce
chimique capable de céder au moins un proton
H+.
- Une base est une espèce
chimique capable de capter au moins un proton
H+. - Pour le
B.B.T, on peut donner
l’écriture formelle suivante :
- Cette écriture est une schématisation, - elle ne traduit pas effectivement ce qui se passe en solution.
-
Le
proton
H+
n’existe pas en solution aqueuse, il est solvaté. -
De même pour l’acide éthanoïque
on peut donner une écriture formelle :
- La réaction entre l’ion In – et la molécule CH3COOH s’interprète - comme un transfert de proton entre la molécule CH3COOH et l’ion In– :
-
c’est une réaction acido-basique. - Définition : - Une réaction qui met en jeu un transfert de protons H+ entre ses réactifs
-
est une réaction acido-basique.
|
a)- Interprétation de l’expérience 2 :
- Au cours de la transformation chimique qui a lieu lors de l’expérience 2 (reproduire le tableau et cocher les bonnes cases) :
|
La molécule H In |
La molécule NH3 |
||
|
□
a gagné |
□ un atome d’hydrogène |
□
a gagné |
□ un atome d’hydrogène |
|
□ un proton H+ |
□ un proton H+ |
||
|
□ a perdu |
□ a perdu |
||
|
□
un anion
H– |
□
un anion
H– |
||
|
La molecule
H In |
La molécule NH3 |
||
|
□
a gagné |
□
un atome d’hydrogène |
x
a gagné |
□
un atome d’hydrogène |
|
x
un proton
H+ |
x
un proton
H+ |
||
|
x a perdu |
□ a perdu |
||
|
□
un anion
H– |
□
un anion
H– |
||
b)- Conclusions. Donner les écritures formelles pour chaque cas :
- Écrire les autres couples acide / base qui interviennent, ainsi que les demi-équations correspondantes.
|
- La molécule HIn a perdu un proton H+ pour donner - l’espèce chimique In – (ion acétate ou éthanoate) :
-
La molécule
H In
est un acide au sens de Bronsted.
- La molécule NH3 a gagné un proton H+ pour donner - l’espèce chimique NH4+:
-
La molécule
NH3 est
une base selon Bronsted.
- Selon les conditions expérimentales, - il est possible de passer de l’acide HIn
-
à la base
In–
ou de réaliser la transformation inverse.
- Les deux espèces HIn et In– sont dites espèces acide et base conjuguées. - Elles forment un couple acide base que l’on note :
-
H In
/
In
–.
- Au couple acide / base H In / In –,
-
on associe la demi-équation acido-basique suivante :
- Le signe égal traduit la
possibilité de passer d’une forme à l’autre selon les conditions
expérimentales. |
- Couple :
CH3COOH
/ CH3COO –
|
CH3COOH
=
H+
+
CH3COO – |
- Couple :
NH4+
/ NH3
|
NH4+
=
H+
+
NH3 |
4)- Réaction entre l’acide chlorhydrique et le B.B.T.
a)- Expérience :
![]() Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme basique bleue.
Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme basique bleue.
- On donne à la solution la formule suivante : Na + (aq). + In – (aq).
- Ajouter quelques gouttes d’acide chlorhydrique (H3O+ (aq). + Cl – (aq).) .
- Observer l’évolution de la couleur de la solution obtenue au cours de l’ajout.
b)- Compte-rendu.
![]() Faire des schémas légendés des différentes situations.
Faire des schémas légendés des différentes situations.
|
- Au fur et à mesure que l’on ajoute la solution d’acide chlorhydrique (incolore), - le mélange réactionnel change de couleur. - Lorsque la solution est jaune, le
B.B.T est sous sa forme
acide notée
H In
(aq). - Au cours de la réaction,
il se forme la molécule
H In
(aq). |
- Quelle espèce chimique formée au cours de la transformation chimique peut-on identifier ?
- D’où provient cette espèce chimique ?
- Écrire l’équation de la réaction qui se produit. Donner les couples acide / base qui interviennent.
- Donner les écritures formelles. Qualifier cette réaction.
|
- On ajoute de l’acide chlorhydrique, la solution passe du bleu au vert,
-
puis au
jaune (forme acide du B.B.T). - En conséquence, au cours de la réaction,
-
il se forme l’espèce chimique
H In
(aq). - L’ion Na+ (aq) est spectateur, il ne participe pas à la réaction,
-
il assure la
neutralité électrique de la solution
comme l’ion chlorure
Cl
–
(aq. - D’après la formulation de l’acide chlorhydrique, - le proton H+ ne peut provenir que de l’ion oxonium H3O+.
-
En perdant un
proton, il donne de l’eau
H2O.
- Équation de la réaction : In – (aq) + H3O+ (aq) → HIn (aq) + H2O - Il y a un transfert de proton :
c’est une réaction acido-basique.
- Les couples :
HIn
/
In
–
et
H3O+
/ H2O - Schéma formel :
In
–
+
H+
=
HIn
H3O+
=
H+
+
H2O - Une réaction acido-basique est bien un transfert de proton
-
entre un acide d’un couple et la base
d’un autre couple. |
5)- Réaction entre une solution aqueuse d’hydroxyde de sodium (soude) et le B.B.T.
a)- Expérience :
![]() Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme acide jaune.
Dans un tube à essais, introduire quelques mL de solution de
B.B.T de forme acide jaune.
- Ajouter quelques gouttes une solution de soude de formule (Na + (aq) + HO – (aq)).
- Observer l’évolution de la couleur de la solution obtenue au cours de l’ajout.
b)- Compte-rendu.
![]() Faire des schémas légendés des différentes situations.
Faire des schémas légendés des différentes situations.
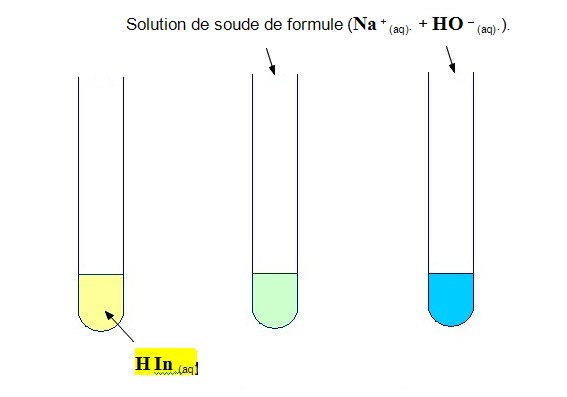
- Quelle espèce chimique formée au cours de la transformation chimique peut-on identifier ?
- D’où provient cette espèce chimique ?
- Écrire l’équation de la réaction qui se produit. Donner les couples acide / base qui interviennent.
- Donner les écritures formelles. Qualifier cette réaction.
|
- On ajoute de la soude, la solution passe du jaune au vert,
-
puis au bleu (forme
basique du B.B.T). - En conséquence, au cours de la réaction,
-
il se forme l’espèce chimique
In
– (aq). - L’ion Na + (aq) est spectateur, il ne participe pas à la réaction,
-
il assure la
neutralité électrique de la solution. - Ce sont les ions hydroxyde HO – qui captent un proton
-
pour donner des molécules d’eau
H2O.
- Équation de la réaction :
HIn
(aq) + HO–
(aq) →
In–
(aq)
+ H2O - Il y a un transfert de proton :
c’est une réaction acido-basique.
- Les couples :
HIn
/
In–
et
H2O
/ HO– - Schéma formel :
In
–
+ H+
= HIn
H2O
= H+
+
HO
– - Une réaction acido-basique est bien un transfert de proton
-
entre un acide d’un couple et la base
d’un autre couple. |
II- Réaction entre l’acide chlorhydrique et le benzoate de sodium.
![]() Mode opératoire :
Mode opératoire :
- Dans un tube à essais, verser 2 mL de solution de benzoate de sodium de concentration C = 0,10 mol / L.
- Ajouter petit à petit par 0,50 mL, à l’aide d’une pipette graduée munie de sa propipette, 2 mL
d’acide chlorhydrique de concentration C = 1,0 mol / L.
![]() Faire des schémas légendés.
Faire des schémas légendés.

- Quelle espèce chimique formée au cours de la transformation chimique peut-on identifier sachant
que l’acide benzoïque est peu soluble dans l’eau ?
- écrire l’équation bilan de la réaction qui se produit.
- On indique que les ions Na + (aq) et Cl – (aq. sont spectateurs et que le benzoate de sodium a la formule suivante en solution aqueuse :
- (Na + (aq) + C6H5COO – (aq)).
- Donner les couples acide / base qui interviennent. Donner les écritures formelles. Qualifier cette réaction.
|
- Équation de la réaction
chimique :
H3O+
(aq) + C6H5COO
–
(aq) →
C6H5COOH
(aq) + H2O - L’ion benzoate a capté un proton pour donner l’acide benzoïque.
-
L’ion benzoate est une
base.
- Couple acide / base :
C6H5COOH
/ C6H5COO
– - Schéma formel :
C6H5COOH
=
H+
+
C6H5COO
– - L’ion oxonium
H3O+
a
perdu un proton : c’est un acide.
- Couple acide / base :
H3O+/
H2O - Schéma formel :
H3O+
= H+ +
H2O |
III- Réaction entre l’acide benzoïque et la soude.
![]() Mode opératoire :
Mode opératoire :
- Étape 1 : dans un tube à essais, déposer 2 cristaux d’acide benzoïque. Ajouter de l’eau distillée et agiter.
- Étape 2 : ajouter goutte à goutte de la soude de concentration c = 1,0 mol / L. Agiter entre chaque ajout.
![]() Qu’observe-t-on lors de l’étape 1 ? De l’étape 2 ? Conclure.
Qu’observe-t-on lors de l’étape 1 ? De l’étape 2 ? Conclure.
- Quelle espèce chimique est formée au cours de la transformation chimique.
- écrire l’équation bilan de la réaction qui se produit.
- On indique que les ions Na + (aq) et Cl – (aq) sont spectateurs.
- Donner les couples acide / base qui interviennent. Donner les écritures formelles. Qualifier cette réaction.
|
- Équation de la réaction
chimique : HO – (aq) + C6H5COOH (aq)) → C6H5COO– (aq) + H2O - Lors de l’ajout de soude, l’acide benzoïque disparait
-
pour donner les ions benzoate soluble
dans l’eau. - Il y a un transfert de proton de l’acide benzoïque
- vers les ions hydroxyde
HO
–. - L’acide benzoïque cède un proton :
-
c’est une espèce chimique acide. - L’ion hydroxyde capte un
proton : c’est une base.
- Couple acide / base :
C6H5COOH
/ C6H5COO
–
- Schéma formel :
C6H5COOH
=
H+
+
C6H5COO
–
- Couple acide / base :
H2O
/ HO
–
- Schéma formel :
H2O
=
H+
+
HO
– |
IV- Réaction mettant en jeu les ions hydrogénocarbonate et carbonate.
1)- Le dioxyde de carbone en solution aqueuse.
![]() Expérience :
Expérience :
- Dans un tube à essais, verser 1 mL de B.B.T (bleu) et 2 mL d’eau distillée.
- Faire buller du dioxyde de carbone en soufflant avec une paille.
![]() Observations et interprétation.
Observations et interprétation.
- Écrire l’équation bilan de la réaction sachant que l’on obtient des ions hydrogénocarbonate de formule : HCO3 –
|
- La solution prend une teinte jaune.
-
Il se forme :
H In.
In
– (aq) + (CO2,
H2O)
→ HIn
(aq) + HCO3 –
(aq)
- L’espèce (CO2,
H2O) perd un proton, c’est un acide pour donner l’ion
HCO3 –
. - C’est une réaction
acido-basique.
- Couples : (CO2,
H2O) / HCO3–
et
HIn
/ In– |
2)- Hydrogénocarbonate de sodium et carbonate de sodium.
![]() Mode opératoire :
Mode opératoire :
- Tube à essais A :
- Verser 2 mL d’eau distillée et une pincée d’hydrogénocarbonate de sodium.
- Agiter et ajouter 1 à 2 gouttes de phénolphtaléine.
- Tube à essais B :
- Verser 2 mL de solution diluée de carbonate de sodium.
- Ajouter 1 à 2 gouttes de phénolphtaléine.
![]() Faire les schémas légendés. Indiquer les observations.
Faire les schémas légendés. Indiquer les observations.
![]() Expérience :
Expérience :
- Prendre le tube A, adapter un tube à dégagement et chauffer le tube A.
- Plonger le tube à dégagement dans le tube B.
- Sortir le tube à dégagement du tube B avant d’arrêter le chauffage.
![]() Faire les schémas légendés.
Faire les schémas légendés.
- Indiquer les observations.
- Interpréter le phénomène sachant que la phénolphtaléine est incolore en milieu acide et rose fuchsia en milieu basique.
|
- En chauffant, il se dégage du dioxyde de carbone qui passe dans la solution B.
-
L’espèce (CO2,
H2O)
réagit avec les
ions carbonate
CO3 2 –. - Tube B : - Équation de la réaction :
(CO2,
H2O)
+
CO3
2 –
(aq) → HCO3 –
(aq) + HCO3 –
(aq) - On est en présence d’une réaction
acido-basique. - L’espèce chimique (CO2, H2O) cède un proton :
-
c’est un acide. L’espèce
HCO3 –
est
sa base conjuguée. - L’espèce HCO3 – est un ampholyte. - Il peut se comporter comme un acide dans un couple
-
et
une base dans un autre couple. - Couples acide / base : (CO2,
H2O) /
HCO3 –
et
HCO3 –
/
CO3
2 –. - Tube A : - En chauffant, il se produit la réaction suivante qui donne
-
un dégagement
de dioxyde de carbone :
HCO3 –
(aq) + HCO3 –
(aq) →
(CO2,
H2O) +
CO3
2 –
(aq) - Couples mises en jeu : (CO2,
H2O)
/
HCO3 –
et
HCO3
–
/
CO3
2 –
- Schémas formels :
HCO3
–
(aq)
+
H+
=
(CO2,
H2O) |