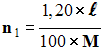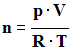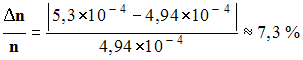TP Chimie N° 03 Suivi d'une transformation chimique. Correction, Première
S
|
TP
Chimie N° 03 |
Suivi
d’une
transformation chimique
Correction
Enoncé
|
|
|
Objectifs :
=>
Étudier une transformation chimique
mettant en jeu des espèces
solides et gazeuses en solution aqueuse.
=>
Mesurer des quantités de matière gazeuse
à température et
pression constants.
=>
Faire un tableau d’avancement de la réaction.
=>
Identifier le réactif limitant
et prévoir l’état final du
système.
|
|
Matériel :
|
Solution
d’acide chlorhydrique de concentration
C = 0,50 mol / L,
Solution de
soude de concentration
C = 1,0 mol / L,
un ruban de
magnésium,
tubes à essais, tube à dégagement,
cristallisoir, éprouvette
graduée de 25 mL,
allumettes, gants et lunettes, bouchons.
|
I-
Étude
qualitative de la réaction entre l’acide chlorhydrique et le magnésium.
1)-
Expériences.
 Expérience 1 :
Expérience 1 :
|
- Dans un tube à essais n° 1,
- Verser
2 mL de la solution d’acide chlorhydrique à 0,50 mol / L,
-
Puis
introduire un petit morceau de ruban de magnésium (
2 cm
).
-
Bouchez un instant avec un bouchon.
-
Craquer une allumette et la
présenter à l’ouverture du tube à essais n° 1 tout en enlevant le
bouchon.
-
Puis laisser l’expérience se poursuivre.
|
 Expériences complémentaires :
Expériences complémentaires :
|
- Test 1 :
- Prélever environ 1 mL de la solution obtenue dans
un tube à essais n° 2
- Et ajouter avec précaution quelques mL de soude et
observer.
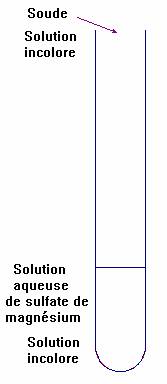
- Test 2 :
- Dans un tube à essais n° 3,
- Verser 1 mL de
solution aqueuse de sulfate de magnésium.
- Ajouter quelques gouttes de soude
et observer.
|

2)-
Compte-rendu :
- Faire les schémas des différentes étapes.
|
-
Expérience 1 :
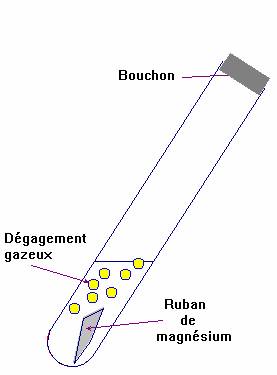
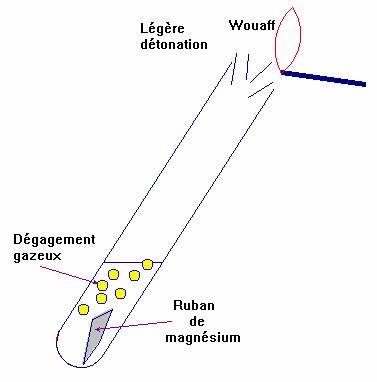
|
- Donner la nature du gaz qui produit une légère détonation en
présence d’une flamme.
|
-
Le gaz qui produit une légère détonation
en présence
d’une flamme est le dihydrogène H2.
|
- Comparer le résultat des deux tests pratiqués. Que peut-on en
déduire ?
- Quels
sont les ions formés lors de la réaction entre l’acide chlorhydrique et le magnésium ?
- écrire l’équation de la réaction qui se produit dans les tubes
n° 2 et 3.
|
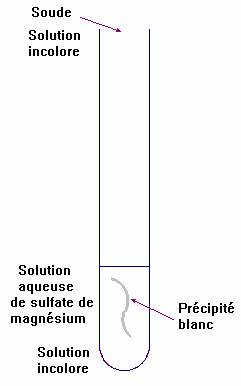
- Expériences complémentaires :
- Test 1 :
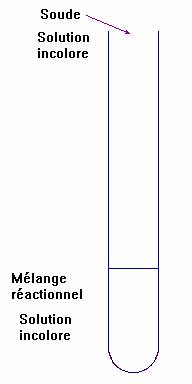
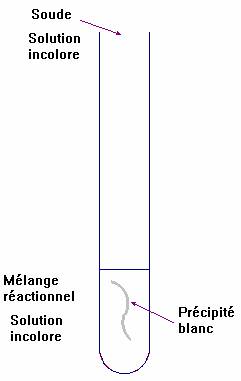
- Test 2 :
|
|
- Résultat des deux tests :
-
Test 2 :
-
Ce test est caractéristique des ions magnésium.
-
Il permet de les mettre en évidence.
-
Solution aqueuse de sulfate de magnésium :
- Cette
solution contient les ions sulfate
SO42–
(aq)
et les ions magnésium
Mg
2+
(aq).
-
La formule de la solution aqueuse est la suivante :
{
Mg
2+
(aq) +
SO
42–
(aq) }
-
La solution aqueuse de soude contient les
- ions sodium
Na+
(aq)
-
et les ions hydroxyde
HO
–
(aq).
-
La formule de la solution aqueuse
est la suivante :
{
Na+
(aq)) +
HO
–
(aq) }
-
Les ions magnésium et les ions hydroxyde sont
incompatibles.
-
Lorsqu’on verse la soude dans une solution contenant
des ions magnésium,
- Ces ions réagissent et s’éliminent.
-
Il se
forme un précipité blanc d’hydroxyde de magnésium :
-
Il se
produit la réaction suivante :
Mg2+
(aq)
+
2 HO
–
(aq)
→
Mg(OH)2
(s)
-
Le test 1 met en évidence la présence d’ions magnésium
dans le mélange réactionnel.
-
Dans le tube n°1 :
- on a mis en présence
- du magnésium à
l’état solide Mg
(s)
-
et une solution aqueuse d’acide chlorhydrique de formule :
{ H+
(aq) +
Cl–
(aq) }
-
Au cours de la réaction il se forme :
- des ions magnésium
Mg2+
(aq) (mis en évidence par le test 1)
-
et on observe un dégagement
de dihydrogène H2.
|
- Écrire l’équation de la transformation chimique qui se
produit dans le tube n° 1 sachant que les ions chlorure ne participent pas au
bilan de la réaction.
|
-
Équation de la transformation chimique :
Mg
(s) +
2 H+
(aq)
→
Mg2+
(aq) +
H 2
(g)
|

II-
Étude
quantitative de la réaction suivie par mesure de volume gazeux à T et P
constants.
1)-
Préparation du montage et calculs préliminaires.
a)- Préparer une cuve à eau. Mesurer la température de l’eau
θ1
et celle de l’air ambiant
θ2.
|
- θ1 = 20,2 ° C
- θ2 = 23,3 ° C
|
b)- Un mètre de magnésium en ruban a une masse
m1
=
1,2 g
.
-
On utilise
1 cm
, ou
1,5 cm
, ou
2 cm
de ruban de magnésium.
 Déterminer la quantité de matière
n1
de magnésium utilisé. On donne : M (Mg) = 24,3 g / mol.
Déterminer la quantité de matière
n1
de magnésium utilisé. On donne : M (Mg) = 24,3 g / mol.
|
Longueur
du ruban
de magnésium
|
Quantité
de
matière de
magnésium utilisé
n1
en mol
|
Formule
|
|
ℓ1
=
1,00 cm
|
4,94
×
10– 4
|
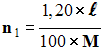
|
|
ℓ2
=
1,50 cm
|
7,41
×
10– 4
|
|
ℓ3
=
2,00 cm
|
9,88
×
10– 4
|
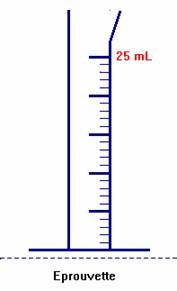
c)- Pour l’acide chlorhydrique, on utilise une éprouvette graduée
de 25 mL que l’on remplit à ras bord.
-
Le volume total d’acide
chlorhydrique versé dans l’éprouvette est
V2 = 39 mL et
la concentration de la solution est
C2 = 0,50
mol / L
 Déterminer la quantité de matière
n2 d’ions
H
+(aq)
contenue dans l’éprouvette.
Déterminer la quantité de matière
n2 d’ions
H
+(aq)
contenue dans l’éprouvette.
|
-
Quantité de matière d’ions hydrogène
H+(aq) :
-
n2
= [
H+
] . V2
-
n2
= 0,50
× 39
× 10– 3
-
n2
= 1,95
× 10– 2
mol
-
n2
≈ 2,0
× 10– 2
mol
|
 Quel est le réactif limitant de la réaction entre le magnésium
et l’acide chlorhydrique ?
Quel est le réactif limitant de la réaction entre le magnésium
et l’acide chlorhydrique ?
|
-
En fin de réaction, on s’aperçoit que le ruban de
magnésium
a complètement disparu.
-
Le réactif limitant est le magnésium
Mg
(s).
|

2)-
Expérience et mesure.
|

|
Il faut utiliser les gants et les lunettes.
|
|
a)- Remplir avec précaution une éprouvette graduée de 25 mL avec
une solution d’acide chlorhydrique
de concentration
C2
= 0,50 mol / L
-
Boucher l’extrémité de l’éprouvette graduée avec un carré de papier.
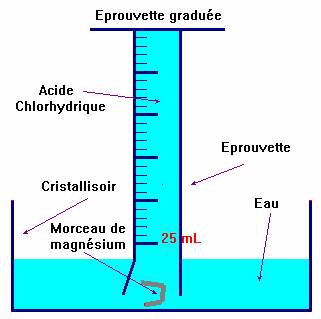
b)- Placer le morceau de magnésium plié en deux au fond de la cuve
à eau.
c)- Le coiffer avec l’éprouvette remplie d’acide que l’on
retourne délicatement sur la cuve à eau.
-
Retirer lentement le carré de
papier.
-
Équilibrer les volumes
d’eau et d’acide en rajoutant éventuellement de l’eau dans la cuve
(le
niveau du liquide dans l’éprouvette est plus haut que le niveau de liquide
dans la cuve).
|
 Faire les schémas légendés des différentes étapes de
l’expérience et indiquer les observations.
Faire les schémas légendés des différentes étapes de
l’expérience et indiquer les observations.
|
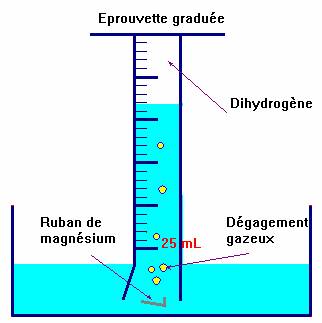
-
Schémas :
On remplit l’éprouvette de la solution
d’acide chlorhydrique.

|
 Noter le volume
V
de gaz en fin de réaction
Noter le volume
V
de gaz en fin de réaction
(il faut faire en sorte que la pression du gaz dans
l’éprouvette soit sensiblement égale à la pression atmosphérique) :
-
Il faut que le niveau du liquide dans l’éprouvette soit pratiquement à la même hauteur
que le niveau du liquide dans la cuve).
|
-
Volume de gaz en fin de réaction :
|
V1
|
V2
|
V3
|
|
13,5 mL
|
20,5 mL
|
28,1 mL
|
|
 À quelle pression se déroule l’expérience ?
À quelle pression se déroule l’expérience ?
|
-
L’expérience se déroule à la pression atmosphérique
si on équilibre les niveaux.
|
|
-
Valeur de la pression :
p
≈ 971,5 hPa
|
 Pourquoi la réaction s’arrête-t-elle ? Quel est le réactif
limitant ?
Pourquoi la réaction s’arrête-t-elle ? Quel est le réactif
limitant ?
|
-
La réaction s’arrête par manque d’un des réactifs,
ici le magnésium
- (il disparaît en fin de réaction)
-
On dit que le magnésium est le réactif limitant.
|
 Quelles sont les causes d’incertitude sur la mesure du volume
de gaz formé ?
Quelles sont les causes d’incertitude sur la mesure du volume
de gaz formé ?
|
-
Il y a des incertitudes au niveau de la mesure de la
pression
et au niveau de la lecture de la valeur du volume de gaz dégagé.
|
 Calculer la valeur de la quantité de matière
n
de dihydrogène formé.
Calculer la valeur de la quantité de matière
n
de dihydrogène formé.
|
-
Quantité de matière
n
de dihydrogène formé :
|
N° 1
|
N° 2
|
N° 3
|
Formule
|
|
n
mol
|
n
mol
|
n
mol
|
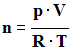
|
|
5,3
×
10– 4
|
8,1
× 10– 4
|
1,1
× 10– 3
|
|

III-
Récapitulatif.
1)-
Établir et remplir un tableau d’avancement de la réaction.
|
-
Tableau d’avancement de la réaction :
-
La grandeur x représente l’avancement, en mole,
de la réaction à l’instant t.
-
On représente le système à différents instants :
-
à l’instant initial (avant le mélange), au cours de
la transformation et à l’instant final (lorsque la réaction est
terminée).
|
Équation
|
Mg
(s)
|
+
2 H+
(aq)
|
→
|
Mg2+
(aq)
|
+
H2
(g)
|
|
État du
système
|
Avanc.
|
mol
|
mol
|
|
mol
|
mol
|
|
État initial
(mol)
|
x = 0
|
n1 = 4,94
× 10– 4
|
n2 =
2,0
× 10– 2
|
0
|
0
|
|
Au cours
de la
transformation
|
x
|
4,94
× 10– 4
– x
|
2,0
× 10– 2
– 2 x
|
x
|
x
|
|
État final
(mol)
|
x =
xmax
|
4,94
× 10– 4
– xmax
|
2,0
× 10– 2
– 2 xmax
|
|
xmax
|
xmax
|
|
4,94
× 10 –
4
|
0
|
1,9
× 10– 2
|
|
4,94
× 10– 4
|
4,94
×
10– 4
|
|
2)-
Comparer la quantité de matière de dihydrogène obtenue
n
à la quantité de matière théorique
nthéo. Conclure.
|
|
N° 1
|
N° 2
|
N° 3
|
|
Valeurs
expérimentales
|
5,3
×
10– 4
|
8,1×
10– 4
|
1,1
× 10– 3
|
|
Valeurs théoriques
|
4,94
×
10– 4
|
7,41
×
10– 4
|
9,88
× 10– 4
|
|
Précision
|
7,3 %
|
9,3 %
|
8,4 %
|
|
-
Les valeurs sont du même ordre de grandeurs.
-
L’imprécision est surtout liée à la mesure de la
valeur du volume de gaz dégagé et à la mesure de la pression du
gaz.
-
Précision de la mesure :
-
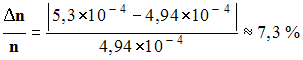
-
La précision est médiocre.
- On ne pouvait pas espérer
mieux avec le matériel utilisé. |