|
|
|
Applications : 2)- Rechercher les réactifs et les produits |
|
Exercices : 7)- On enflamme une bûchette de bois |
1)-
Exercice 5 page 330.
|
Chim. N° 09
La réaction chimique.
|
|
Programme 2011 :
Programme 2020 :
|
|
|
Applications : 2)- Rechercher les réactifs et les produits |
|
Exercices : 7)- On enflamme une bûchette de bois |
1)-
Exercice 5 page 330.
|
Trouver la réaction chimique : On
introduit, dans un tube à essai, une solution de chlorure de baryum, (Ba2+
(aq) + 2 Cl
– (aq) ) et une
solution de sulfate de sodium, (2
Na+ (aq) +
SO4
2– (aq) ). Un
précipité blanc de sulfate de baryum apparaît.
1)-
Rechercher les réactifs et les produits de cette transformation. 2)-
Quelle est la réaction qui modélise cette transformation ? |
|
Trouver la réaction chimique : Solution de chlorure de baryum : (Ba2+
(aq) + 2 Cl
– (aq) ) Solution de sulfate de sodium :(2
Na+ (aq) +
SO4
2– (aq) ). Précipité blanc de sulfate de baryum :
1)- Les réactifs et les produits de cette
transformation. - Les réactifs : - Les ions baryum :
Ba2+ (aq) - Les ions sulfate :
SO4 2– (aq) - Les produits : le sulfate de baryum :
BaSO4 (s) - Les ions chlorure et les ions sodium sont des
ions spectateurs. - Ils ne participent pas à la réaction
chimique. - Ils coexistent dans la même solution et
assurent l’électroneutralité de la solution. 2)- Équation chimique :
Ba2+
(aq) + SO4 2– (aq) →
BaSO4 (s) |
2)- Exercice 08 page 330.
![]()
|
Rechercher les réactifs et les produits : On considère une solution
S1 incolore
de nitrate de plomb,
Pb2+ (aq) + 2
NO3 –
(aq) Et une solution S2
incolore d’iodure de potassium,
K+ (aq) +
I–
(aq). On mélange dans un tube à essai 3 mL de
S1 et 2 mL de
S2.
1)- Décrire l’état initial du système après mélange et avant
transformation. 2)- Lors du mélange, on observe l’apparition d’un précipité jaune. Une transformation chimique a-t-elle eu lieu ? 3)- L’espèce chimique formée, électriquement neutre, contient les
ions plomb et iodure. Quelle est sa formule ? 4)- L’ion Pb2+
(aq) disparaît totalement. Décrire l’état final du système. 5)- Écrire l’équation de la réaction chimique modélisant cette
transformation. |
|
Rechercher les réactifs et
les produits Solution
S1 incolore
de nitrate de plomb : Pb2+
(aq) + 2 NO3
– (aq) Solution
S2 incolore
d’iodure de potassium : K+
(aq) +
I– (aq). On mélange : il se forme un précipité jaune 1)- État initial du système après mélange
et avant transformation.
2)- Lors du mélange, on observe
l’apparition d’un précipité jaune. - Comme il apparaît une nouvelle espèce
chimique (le précipité jaune), une réaction chimique se produit. 3)- Formule de la nouvelle espèce
chimique : PbI2
(s) Nom : iodure de plomb II 4)- État final du système :
5)- Équation de la réaction chimique
modélisant cette transformation.
Pb2+
(aq) + 2 I–
(aq) → PbI2
(s)
|
3)- Exercice 9 page 331 : Écrire une équation
|
Écrire une équation : On introduit dans un tube à essai T de la grenaille de zinc
Zn (s) et en environ 2 mL d’une solution aqueuse d’acide chlorhydrique,
H+ (aq) +
Cl–
(aq).
Un dégagement gazeux se produit
(a). Après avoir bouché le tube quelques instants,
On présente une Après quelques minutes, on prélève un peu de la solution et On ajoute goutte à goutte une solution d’hydroxyde de sodium : Un précipité blanc apparaît
(b). 1)- Décrire l’état initial de ce système après mélange et avant
transformation. 2)- Quel est le gaz mis en évidence ? 3)- Quel est l’ion caractérisé par la formation du précipité ? 4)- a)- Quelles sont les espèces chimiques affectées par la transformation ayant lieu dans le tube
T ? b)- Sachant que l’eau n’est pas un réactif, préciser la nature des réactifs et des produits et écrire l’équation chimique correspondante. c)- Quel est le bilan en quantité de matière traduit par cette
équation ? |
|
Écrire une équation : On introduit dans un tube à essai T de la
grenaille de zinc Zn (s) et en environ 2 mL d’une solution aqueuse
d’acide chlorhydrique, H+
(aq) +
Cl– (aq). Un dégagement gazeux se produit
(a).
Un précipité blanc apparaît
(b).
1)- État initial de ce système après
mélange et avant transformation.
2)- Gaz mis en évidence : - Le gaz qui provoque une légère détonation
en présence d’une flamme est le dihydrogène
H2 (g). 3)- Ion caractérisé par la formation du
précipité : - Le précipité blanc obtenu est de
l’hydroxyde de zinc II :
-
Zn(OH)2
(s). - Cette réaction chimique permet de mettre
en évidence - les ions
Zn2+ (aq) 4)- a)- Espèces chimiques affectées par la
transformation ayant lieu dans le tube
T : - Ce sont les réactifs :
Zn (s) et
H+ (aq) b)- Nature des réactifs et des produits : - Les réactifs :
Zn (s) et
H+ (aq) - Les produits :
H2 (g) et
Zn2+ (aq) - Équation chimique correspondante.
Zn
(s) + 2
H+ (aq) →
Zn2+ (aq) +
H2 (g) c)- bilan en quantité de matière que
traduit par cette équation : Au cours de cette réaction chimie, La disparition d’une mole de zinc métal
Zn (s) s’accompagne de la disparition de deux
moles ions hydrogène H+
(aq). Il se forme alors une mole d’ions zinc II
Zn2+ (aq) et une mole de dihydrogène gazeux
H2 (g). |
4)- Exercice 11 page 331 :
Ajuster des nombres stœchiométriques :
|
Ajuster des nombres stœchiométriques : 1)- N2 (g) +
H2 (g) →
NH3 (g)
2)- Na (s) +
Cl2 (g) →
NaCl (s)
3)- Fe (s) +
O2 (g) →
Fe3O4 (s)
4)- C2H6
(g) + O2 (g) →
CO2 (g) +
H2O (g)
5)-
CH4 (g) + Cl2
(g) → CHCl3
(ℓ) + HCl (g) |
|
Ajuster des nombres stœchiométriques : 1)- N2 (g) +
H2 (g) →
NH3 (g)
N2 (g) + 3
H2 (g) → 2
NH3 (g)
2)- Na (s) +
Cl2 (g) →
NaCl (s)
2 Na (s) +
Cl2 (g) → 2
NaCl (s)
3)- Fe (s) +
O2 (g) →
Fe3O4 (s)
3 Fe (s) + 2
O2 (g) →
Fe3O4 (s)
4)- C2H6
(g) + O2 (g) →
CO2 (g) +
H2O (g)
2 C2H6
(g) + 7 O2 (g)
→ 4 CO2 (g) +
6 H2O (g)
5)-
CH4 (g) + Cl2
(g) → CHCl3
(ℓ) + HCl (g)
CH4 (g) + 3
Cl2 (g) →
CHCl3 (ℓ) + 3
HCl (g) |
5)- Exercice 19 page 332 : Combustion d'un alcane.
|
Combustion d’un alcane. Un alcane gazeux A a pour formule CnH2n
+ 2. La combustion complète d’une mole de A
donne quatre moles de dioxyde de carbone et de l’eau
à l’état gazeux. 1)- Déterminer la formule brute de A. 2)- écrire l’équation de combustion de A. 3)- Montrer qu’il existe deux formules
semi-développées possibles pour A. Que représente ces deux formules ? |
|
Combustion d’un alcane. Formule de l’alcane gazeux A :
CnH2n + 2. Équation de combustion de l’alcane A : CnH2n
+ 2 (g) +
(3 n + 1)/2 O2 (g) →
n CO2 (g) +
(n + 1) H2O
(g)
1)- Formule brute de A. - Formule de l’alcane gazeux A :
C4H10 2)- Équation de combustion de A. C4H10
(g) + (13)/2 O2
(g) → 4 CO2 (g) +
(5) H2O (g) Ou
2
C4H10
(g) + 13 O2 (g) →
8 CO2 (g) +
10 H2O (g) 3)- Les deux formules semi-développées
possibles pour A.
On est en présence de molécules isomères
(isomérie de chaîne). |
6)- Exercice 10 page 148 : Transformation chimique ou non
|
- Dans les transformations suivantes, préciser s’il s’agit d’une transformation chimique et, dans l’affirmative, donner l’état initial et l’état final. -
Un radiateur électrique qui chauffe : -
Une lampe électrique qui s’éclaire : -
L’extraction de l’essence de lavande. -
Un moteur diesel qui fonctionne : -
Un moteur à essence qui fonctionne : |
|
- Dans les transformations suivantes, préciser s’il s’agit d’une transformation chimique et, dans l’affirmative, donner l’état initial et l’état final. -
Un radiateur électrique qui
chauffe : -
Ceci est dû au passage du courant dans une résistance. -
La chaleur est produite par effet Joule. -
Il ne s’agit pas d’une transformation chimique. -
Une lampe électrique qui s’éclaire : -
Ce phénomène est dû au passage du courant dans le filament
d’une lampe. -
Ce filament porté à haute température ( c’est le
phénomène d’incandescence. -
Il ne s’agit pas d’une réaction chimique. -
L’extraction de l’essence de
lavande. -
Cette opération consiste à extraire les huiles essentielles
présentes dans la fleur de lavande. -
On réalise un entraînement à la vapeur c’est-à-dire une
distillation simple. - Il s’agit d’une transformation physique (changement d’état), on passe de l’état liquide à l’état gazeux puis de l’état gazeux à l’état liquide. -
Il ne s’agit pas d’une transformation chimique. -
Un moteur diesel qui fonctionne :
-
Il s’agit ici d’une réaction chimique faisant intervenir un
combustible (le gazole) et un comburant le dioxygène de l’air. -
Le gazole est un mélange d’hydrocarbures liquides. -
Il faut -
État initial : gazole et air. -
État final : dioxyde de carbone, eau et autres. -
Un moteur à essence qui
fonctionne : -
Il s’agit ici d’une réaction chimique faisant intervenir un
combustible (l’essence) et un comburant le dioxygène de l’air. -
L’essence est un mélange d’hydrocarbures liquides. -
État initial : essence et air. -
État final : dioxyde de carbone, eau et autres. |
7)- Exercice 13 page 148. On enflamme une bûchette de bois
|
On enflamme une bûchette de bois. a)-
Quels sont les réactifs de
cette combustion ? b)- Quels sont les principaux produits de cette combustion, supposée complète, sachant que les éléments chimiques présents dans le bois sont
essentiellement C, H et O ? c)-
Quel est l’état initial de
cette réaction ? d)-
Donner un exemple d’état
final. e)- On introduit la bûchette enflammée dans un tube à essais vide et sec. La bûchette s’éteint presque immédiatement. En utilisant les termes : réactif, produit et état final, Faire
une phrase qui décrive la raison pour laquelle la bûchette s’est
éteinte. |
|
On enflamme une bûchette de bois. a)-
Quels sont les réactifs de
cette combustion ? -
Le bois et le dioxygène de
l’air. -
Le bois contient
essentiellement de la cellulose qui est un polymère du glucose. b)- Quels sont les principaux produits de cette combustion, supposée complète, sachant que les éléments chimiques présents dans le bois sont essentiellement C, H et O ? -
Les produits de la réaction
de combustion complète sont le dioxyde de carbone CO2
et l’eau H2O. c)-
Quel est l’état initial de
cette réaction ? -
E.I :
La bûchette de bois et air. d)-
Donner un exemple d’état
final. -
E.F :
dioxyde de carbone et vapeur d’eau. e)- On introduit la bûchette enflammée dans un tube à essais vide et sec. La bûchette s’éteint presque immédiatement. En utilisant les termes : réactif, produit et état final, faire une phrase qui décrive la raison pour laquelle la bûchette
s’est éteinte. - Dans l’état final, la réaction chimique s’arrête car l’un des réactifs, le dioxygène a
totalement disparu. |
8)-
Exercice 16 page 149. Ajuster la stœchiométrie des
équations chimiques suivantes
Ajuster la stœchiométrie des équations chimiques suivantes.
a)-
CH4
(g) + O2 (g) → CO2 (g) + H2O
(ℓ)
b)-
C6H4O6
(s) + O2 (g) → CO2 (g) + H2O
(ℓ) c)-
Al
(s) + O2 (g) → Al2O3
(s)
d)-
C4H6
(g) + Cl2 (g) → C4H6Cl4
(g)
e)-
C6H6
(ℓ) + HNO3 (ℓ) → C6H3N3O6
(ℓ) (g) + H2O
(ℓ)
f)-
FeCl3
(s) + MgO (s) → Fe2O3 (s)
+ MgCl2 (s)
Ajuster la stœchiométrie des équations chimiques suivantes.
a)-
CH4
(g) + O2 (g) → CO2 (g) + H2O
(ℓ)
-
CH4
(g) + 2 O2 (g) →
CO2 (g) + 2 H2O
(ℓ)
b)-
C6H4O6
(s) + O2 (g) → CO2 (g) + H2O
(ℓ)
-
C6H4O6
(s) +6 O2 (g) →
6 CO2 (g) +
6 H2O (ℓ) c)-
Al
(s) + O2 (g) → Al2O3
(s) -
4
Al (s) +
3 O2 (g) →
2 Al2O3
(s)
d)-
C4H6
(g) + Cl2 (g) → C4H6Cl4
(g)
-
C4H6
(g) +2 Cl2 (g) →
C4H6Cl4 (g)
e)-
C6H6
(ℓ) + HNO3 (ℓ) → C6H3N3O6
(ℓ) (g) + H2O
(ℓ)
-
C6H6
(ℓ) + 3 HNO3 (ℓ) →
C6H3N3O6
(ℓ) (g) +
3 H2O (ℓ)
f)-
FeCl3
(s) + MgO (s) → Fe2O3 (s)
+ MgCl2 (s)
2
FeCl3
(s) + 3
MgO (s) →
Fe2O3
(s) + 3
MgCl2 (s)
-
Les pluies acides
sont liées à la pollution industrielle et automobile.
-
Une pluie acide est
une solution aqueuse d’acide sulfurique H2SO4
ou d’acide nitrique HNO3. a)-
Pour qu’une
solution soit acide, il faut qu’elle contienne des ions H3O+.
Proposer une
équation chimique qui mette en évidence la formation de
l’ion H3O+ lors
de la réaction de
l’acide sulfurique avec l’eau. b)-
même
question pour la solution d’acide nitrique. c)-
l’origine de l’acide sulfurique dans l’atmosphère est
due à la présence de trioxyde de soufre SO3. Proposer une
équation chimique rendant compte de la production de l’acide
sulfurique et qui mette en jeu
le trioxyde de soufre et une espèce chimique présente dans
les nuages. d)-
le
trioxyde de soufre provient de la combustion d’espèces
chimiques présentes dans le gaz naturel. Pourquoi la
combustion du méthane pur CH4 ne peut-elle
produire d’acide sulfurique ? e)-
Sachant que la
combustion complète d’un hydrocarbure donne uniquement
du dioxyde de
carbone et de l’eau,
écrire l’équation de combustion du
méthane. f)-
Une impureté
courante présente dans le gaz naturel a pour formule brute
CH4S.
Proposer un schéma
de Lewis pour cette espèce. g)-
Montrer par une
équation chimique que la combustion de cette espèce chimique
soufrée
permet la
production, en autres, de trioxyde de soufre. h)-
La formation
d’acide nitrique passe également par la production d’un
oxyde,
mais il s’agit du
dioxyde d’azote NO2.
Montrer qu’il y a
dans l’atmosphère tous les réactifs pour produire du dioxyde
d’azote.dans l’atmosphère
sous forme de dioxygène et de diazote. i)-
Traduire par une
équation chimique que le dioxyde d’azote,
en présence d’eau
et de dioxygène produit de l’acide nitrique. -
Les pluies acides
sont liées à la pollution industrielle et automobile.
-
Une pluie acide est
une solution aqueuse d’acide sulfurique H2SO4
ou d’acide nitrique HNO3. a)-
Pour qu’une
solution soit acide, il faut qu’elle contienne des ions H3O+.
Proposer une
équation chimique qui mette en évidence la formation de
l’ion H3O+ lors
de la réaction de
l’acide sulfurique avec l’eau.
H2SO4
(ℓ) +
H2O
(ℓ) →
H3O+
(aq) +
HSO4
– (aq) Acide
sulfurique Eau Ion
oxonium Ion
hydrogénosulfate
H2SO4
(ℓ) +
2
H2O
(ℓ) →
2
H3O+
(aq) +
SO4
2– (aq) Acide
sulfurique Eau Ion
oxonium Ion
sulfate b)-
même
question pour la solution d’acide nitrique.
HNO3
(ℓ) +
H2O
(ℓ) →
H3O+
(aq) + NO3
– (aq) Acide
nitrique Eau Ion
oxonium Ion
nitrate c)-
l’origine
de l’acide sulfurique dans l’atmosphère est due à la
présence de trioxyde de soufre SO3.
Proposer une
équation chimique rendant compte de la production de l’acide
sulfurique
et qui mette en jeu
le trioxyde de soufre et une espèce chimique présente dans
les nuages.
-
SO3
(s) + H2O (ℓ) → H2SO4
(ℓ) d)-
le
trioxyde de soufre provient de la combustion d’espèces
chimiques présentes dans le gaz naturel.
Pourquoi la
combustion du méthane pur CH4 ne peut-elle
produire d’acide sulfurique ? -
La combustion du
méthane pur ne peut pas produire d’acide sulfurique parce
que l’élément soufre S,
présent dans
l’acide sulfurique n’est pas présent dans les réactifs de la
combustion du méthane pur. -
Le méthane pur
brûle en présence de dioxygène pour donner du dioxyde de
carbone et de l’eau. e)-
Sachant que la
combustion complète d’un hydrocarbure donne uniquement
du dioxyde de
carbone et de l’eau, écrire l’équation de combustion du
méthane. -
CH4
(g) + O2 (g) → CO2 (g) +
H2O (ℓ) f)-
Une impureté
courante présente dans le gaz naturel a pour formule brute
CH4S.
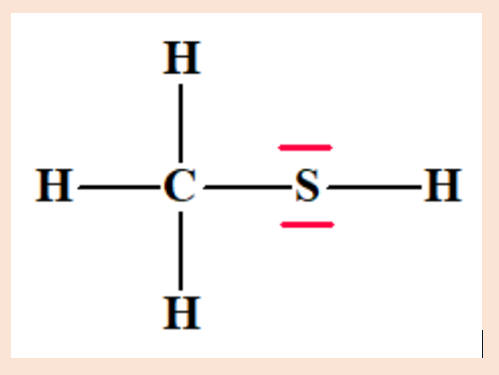
Proposer un schéma
de Lewis pour cette espèce. -
Schéma de Lewis : g)-
Montrer par une
équation chimique que la combustion de cette espèce chimique
soufrée
permet la
production, en autres, de trioxyde de soufre. -
2
CH4S (g) +
7 O2 (g) →
2 SO3 (s) +
2 CO2 +
4 H2O
(ℓ) h)-
La formation
d’acide nitrique passe également par la production d’un
oxyde,
mais il s’agit du
dioxyde d’azote NO2.
Montrer qu’il y a
dans l’atmosphère tous les réactifs pour produire du dioxyde
d’azote. -
Les éléments
chimiques dans le dioxyde de d’azote sont l’oxygène et
l’azote présents
dans l’atmosphère
sous forme de dioxygène et de diazote. i)-
Traduire par une
équation chimique que le dioxyde d’azote,
en présence d’eau
et de dioxygène produit de l’acide nitrique. 4
NO2 (g) + O2 (g) +
2 H2O
(ℓ) → 4 HNO3
(ℓ)
![]()