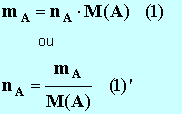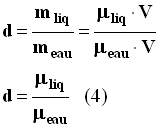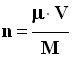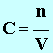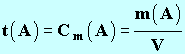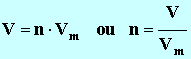|
Chim. N° 01 |
Grandeurs physiques et quantité de matière. Cours. |
|
|
Programme 2011 : Physique et Chimie Programme 2020 : Physique et chimie |
|
3)- Pourquoi mesurer en chimie ?
|
|
II - Quantité de matière d'un solide ou d'un liquide. 1)- Quantité de matière et masse. |
|
III - Quantité de matière d'un gaz. |
|
QCM : Pour s'auto-évaluer La quantité de matière (sous forme de tableau) La quantité de matière (Questy) Pour s'auto-évaluer |
|
énoncé et correction |
|
|
Jeudi 19 Octobre |
Jeudi 9 Novembre |
|
Exercice 3 page 22 |
Exercice 2 page 38 |
|
Exercice 7 page 23 |
Exercice 8 page 39 |
|
Exercice 8 page 23 |
Exercice 12 page 39 |
|
Livre de Chimie Hachette |
Exercice 21 page 41 |
Pour aller plus loin :
|
Mots clés : la mesure en chimie ; quantité de matière d'un solide ; quantité de matière d'un liquide ; quantité de matière d'un gaz ; densité ; masse volumique ; titre massique ; concentration molaire volumique ; masse molaire ; soluté ; solvant ; ... |
|
|
1)- Rappels de seconde :
a)- Structure de la matière.
- La matière est formée à partir d’atomes.
- Un atome est constitué d’un noyau chargé positivement et d’électrons chargés négativement.
|
Un atome de symbole X, de numéro atomique Z et de nombre de masse A possède : - Z protons, - (A - Z) neutrons - et Z électrons. |
- Les atomes peuvent former des édifices plus ou moins complexes.
- Ils peuvent former des molécules dans lesquelles les atomes forment des liaisons covalentes.

- Ils peuvent former aussi des réseaux cristallins :
- Métal : Assemblage compact et ordonné d’atomes identiques
- Cristal ionique : Assemblage compact et ordonné d’ions.

b)- Grandeurs permettant de décrire un système chimique.
|
La mole : - Une mole d’atomes, de molécules ou d’ions est la quantité de matière d’un système contenant 6,02 × 1023 atomes, molécules ou ions. |
- Le nombre d’AVOGADRO :
- On note : NA atomes de carbone 12.
- On doit à Jean Perrin la première détermination de NA en 1923.
|
Le nombre d’AVOGADRO : - Le nombre NA a été appelé constante d’Avogadro, - en hommage à Avogadro, célèbre chimiste et physicien italien (1776 – 1856). - Le nombre NA représente le nombre d’entités élémentaires par mol, - On l’exprime en mol−1 . - Des mesures récentes indiquent qu’il y a 6,022137 × 1023 atomesde carbone 12 dans 12,00 g de carbone 12. - On arrondit cette valeur. - On écrit : - NA = 6,022137 × 1023 mol−1 |
- Conséquence : une mole est un paquet de 6,02 x 1023 entités chimiques identiques.
|
La masse molaire : - La masse molaire d’une espèce chimique est la masse d’une mole de cette espèce chimique. - On symbolise la masse molaire par M. - La masse molaire s’exprime en g / mol ou g . mol−1 - La masse molaire atomique est la masse d'une mole d'atomes de l'espèce considérée. |
- Exemples :
- Masse molaire atomique de l'élément carbone : M (C) = 12,0 g / mol.
- Masse molaire atomique de l'élément oxygène : M (O) = 16,0 g / mol.
- Masse molaire atomique de l'élément cuivre : M (Cu) = 63,5 g / mol.
- Masse molaire atomique de l'élément cuivre : M (Cl) = 35,5 g / mol.
- Dans la nature, il y a 75 % de l’isotope 35 et 25 % de l’isotope 37.
|
La masse molaire moléculaire : La masse molaire moléculaire est la masse d'une mole de molécules de l'espèce considérée. - La masse molaire moléculaire s'obtient en faisant la somme des masses molaires atomiques des atomes qui constituent la molécule. |
- Exemples :
- déterminer la masse molaire moléculaire des espèces chimiques suivantes :
H2O ; Cl2 ; H2SO4 et NH3.
- Masse molaire de la molécule d'eau :
- M (H2O) = M (O) + 2 M (H)
- M (H2O) ≈ 1 x 16,0 + 2 x 1,0
- M (H2O) ≈ 18 g / mol
- Masse molaire du dichlore :
- M (Cl2) = 2 M (Cl)
- M (Cl2) ≈ 2 × 35,5
- M (Cl2) ≈ 71,0 g / mol
- Masse molaire de l'acide sulfurique :
- M (H2SO4) = 2 M (H) + M (S) + 4 M (O)
- M (H2SO4) ≈ 2 × 1,0 + 1 × 32,1 + 4 × 16,0
- M (H2SO4) ≈ 98 g / mol
- Masse molaire de l'ammoniac :
- M (NH3) = M (N) + 3 M (H)
- M (NH3) ≈ 1 × 14,0 + 3 × 1,0
- M (NH3) ≈ 17 g / mol
|
La masse molaire ionique : - La masse molaire ionique est la masse d'une mole d'ions de l'espèce considérée. - On peut négliger la masse des électrons devant la masse du noyau d'un atome. - La masse molaire d'un ion monoatomique est pratiquement égale à celle de l'atome correspondant. |
- Exemples :
- M (Na +) ≈ M (Na)
- M (Cl −) ≈ M (Cl)
|
Elément chimique : |
|||
|
Nom |
Phosphore |
Oxygène |
Soufre |
|
Symbole |
P |
O |
S |
|
Masse molaire g / mol |
31,0 |
16,0 |
32,1 |
- Pour déterminer la masse molaire d'un ion polyatomique, on fait comme pour les molécules.
- Masse molaire de l'ion phosphate : PO43 − :
- M (PO43−) ≈ M (P) + 4 M (O)
- M (PO43−) ≈ 1 × 31,0 + 4 × 16,0
- M (PO43−) ≈ 95,0 g / mol
- Masse molaire de l'ion sulfate : SO42 −
- M (SO42−) ≈ M (S) + 4 M (O)
- M (SO42 −) ≈ 1 × 32,1 + 4 × 16,0
- M (SO42 −) ≈ 96,1 g / mol
|
- Lorsqu’on dissout une espèce chimique dans un liquide on obtient une solution. - L’espèce chimique dissoute est appelée le soluté. - Le liquide dans lequel on dissout l’espèce chimique est appelé le solvant. - Si le solvant utilisé est l’eau, on obtient une solution aqueuse. - Une solution est un liquide homogène contenant plusieurs constituants. - L’espèce chimique mise en solution peut être constituée de : - Molécules (solide moléculaire, liquide ou gaz) - Ou d’ions (solides ioniques). - Le soluté est ionique si la solution obtenue est formée d’ions parmi des molécules d’eau. |
- Exemples :
- C’est le cas de la solution aqueuse de sulfate de cuivre II.
- La solution contient des ions cuivre II et des ions sulfate.
- Lors de la réalisation de la solution avec le cristal ionique, le soluté réagit avec l’eau.
- Le soluté est moléculaire si la solution obtenue contient des molécules de soluté (soluté moléculaire) et des molécules d’eau.
- Lors de la réalisation de la solution, le soluté ne réagit pas avec l’eau.
- C’est le cas de la solution de saccharose (C12H22O11) et de celle du diiode.
- La solution de saccharose contient des molécules de saccharose
- et celle de diiode contient des molécules de diiode et bien sûr des molécules de solvant : l’eau.
3)- Pourquoi mesurer en chimie ?
- Quelques étiquettes :
|
|
|
|
|
|
|
|
- On mesure en chimie, pour informer, pour surveiller, pour protéger et pour agir.
- Pour informer le consommateur, le fabricant indique sur l’emballage la composition du produit.
- Il indique la nature et la masse des espèces qu’il contient.
- Pour surveiller la qualité et la fraîcheur d’un lait, on peut mesure sa densité, son pH.
- De l’air que l’on respire à l’eau que l’on boit, tout est mesuré.
- On réalise des analyses de sang pour dépister certaines maladies, pour connaître les quantités de matière de sucre, de cholestérol, de fer, de magnésium, etc.
- Cela permet d’établir un diagnostic et de donner un traitement.
- On analyse l’air que l'on respire ;
- Pour lutter contre la pollution de l’air, il faut contrôler le taux de monoxyde de carbone et le taux de dioxyde de carbone présents dans les gaz d’échappement des voitures.
- On demande aux automobilistes de rouler plus lentement lorsque le taux d’ozone dépasse 360 μg par m3 d’air dans la basse atmosphère.
- On analyse l’eau que l'on boit : Une eau est potable si sa teneur en nitrate est inférieure à 50 μg par litre.
- La surveillance et la protection de l’environnement, le contrôle de la qualité des produits agroalimentaires nécessite des mesures nombreuses et variées :
- Mesure de la concentration massique, de la densité, du pH, …
II-
Quantité de matière d’un solide ou d’un liquide.![]()
1)- Quantité de matière et masse.
- La quantité de matière d’une espèce chimique ne se mesure pas, elle se détermine grâce à d’autres grandeurs physiques qui elles se mesurent.
- Relation :
|
|
►
nA :
Quantité de matière de l'espèce chimique
considérée
A en mol
► M(A) : Masse molaire de l'espèce
chimique considérée en g / mol
► mA :
Masse de l'espèce chimique considérée en g |
![]() Applications 1 :
calculer
la quantité de matière
n1 d'eau contenue dans un litre d'eau.
Applications 1 :
calculer
la quantité de matière
n1 d'eau contenue dans un litre d'eau.
- On donne : la masse d'un litre d'eau est m1 = 1,00 kg.
- L'eau a une structure moléculaire de formule H2O.
- Masse molaire de la molécule d'eau :
- M (H2O) = 2 M (O) + M (H)
- M (H2O) ≈ 2 × 16,0 + 1 × 1,0
- M (H2O) ≈ 18 g / mol
- Quantité de matière contenue dans un litre d'eau :
|
||||||||
|
||||||||
|
![]() Application 2 :
Application 2 :
- On pèse un morceau de sucre à l’aide d’une balance électronique.
- La pesée donne une masse ms = 5,95 g.
- Déterminer la quantité de matière ms de saccharose que contient ce morceau de sucre ?
- Masse molaire du saccharose : Ms = M (C12H22O11) ≈ 342 g / mol
- Quantité de matière de saccharose :
- 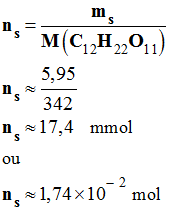
- Conclusion :
- En pratique, pour déterminer la valeur de la quantité de matière d’une espèce solide ou liquide, on peut utiliser la pesée.
- En revanche la pesée d’un échantillon gazeux est très délicate.
- Elle est rarement utilisée pour la détermination de la quantité de matière d’un échantillon gazeux.
2)- Quantité de matière et volume.
a)- La masse volumique.
- Relation :
|
► m
: Masse de l'échantillon considéré en g
► V
: Volume occupé par l’échantillon en m3
► μ
:
Masse volumique de l’échantillon en kg / m3 |
- Remarque : on exprime aussi les masses volumiques en g / cm3 ou g / mL
- Rappel : 1 m3 = 103 dm3 = 106 cm3 = 103 L
b)- Densité d’un liquide.
- C’est une grandeur très utilisée en chimie.
- La densité d’un liquide par rapport à l’eau est égale au rapport entre la masse d’un volume V du liquide et la masse d’un même volume V d’eau.
|
d = |
Masse d'un volume V du liquide |
|
|
|
|
Masse d'un même volume V d'eau |
- Relation : on écrit :
|
(3) |
► La densité est un nombre qui s’exprime sans unité. |
- Remarque : Connaissant la masse volumique du liquide, on peut utiliser la relation suivante
- mliq = μliq . V (4)
- De même pour le volume V d’eau : meau = μeau . V
- On déduit la relation suivante :
|
|
(4) |
►
La densité est un nombre qui s’exprime sans unité. |
- La masse volumique de l’eau :
|
μeau |
1,0 kg / dm 3 |
|
1,0 g / cm 3 |
c)- Relation entre le volume et la quantité de matière d’un échantillon.
- Considérons un échantillon de liquide (exemple : alcool absolu : éthanol)
- Le volume de l’échantillon : V
- La masse volumique de l’échantillon μ
- La masse molaire de l’échantillon M
- La quantité de matière de l’échantillon est donnée par la relation :
- 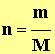 avec
m
=
μ
. V
avec
m
=
μ
. V
- On en déduit la relation suivante :
|
|
(5) |
► μ
: Masse volumique de l’échantillon en kg / m
3
► V
: Volume occupé par l’échantillon en m
3
► M :
Masse molaire de l'espèce chimique considérée en g / mol |
- Attention aux unités :
- La masse molaire s’exprime en g / mol.
- Il faut que les unités de masse et de volume soient cohérentes.
- il faut exprimer la masse volumique en g / L si le volume est exprimé en L ou en g / mL si le volume est exprimé en mL.
![]() Application
3 :
Application
3 :
- L’hexane est un liquide incolore formé de molécule de formule C6H14 et dont la masse volumique est μ = 660 g / L.
- Déterminer la valeur du volume nécessaire, que l’on doit prélever, pour obtenir 0,10 mol d’hexane.
- Données : M (C) = 12,0 g / mol et M (H) = 1,01 g / mol.
- Réponse :
- Volume nécessaire :
- La relation (5) permet d’écrire :
- 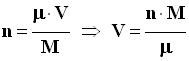
- Masse molaire de l’hexane :
- M = 6 M (C) + 14 M (H)
- M = 6 x 12,0 + 14 x 1,01
- M ≈ 86,0 g / mol
- 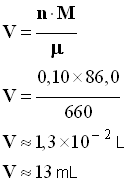
![]() Application
4 : ''à voir''
Application
4 : ''à voir''
3)- Quantité de matière et concentration.
a)- La concentration molaire (volumique).
- La concentration molaire d’une espèce chimique en solution est la quantité de matière de soluté présente dans un litre de solution.
- Relation :
|
|
(6) |
► n
: la quantité de matière de soluté en mol.
► V
; le volume de la solution en L
► C
: la concentration molaire en soluté de la solution aqueuse en mol / L |
- Remarque :
- Cas d’une solution qui contient des molécules de soluté X .
- Il y a deux façons de noter la concentration :
- Soit CX ou [ X ] .
- Exemple pour une solution aqueuse de diiode de concentration 0,020 mol / L, on peut écrire :
- C ( I2) ≈ 0,020 mol / L ou [ I 2] ≈ 0,020 mol / L
- Cas d’une solution ionique.
- Exemple :
- Une solution aqueuse de sulfate de cuivre II.
- C (CuSO4) ≈ 0,020 mol / L ou [ SO4 2 -] ≈ 0,020 mol / L et [ Cu 2 +] ≈ 0,020 mol / L
|
IMPORTANT : - Mais l’écriture : [CuSO 4] ≈ 0,020 mol / L n’a pas de sens. |
b)- Relation entre concentration et quantité de matière.
- Relation :
- 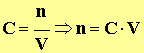 (6‘)
(6‘)
- Application :
- On souhaite préparer un volume V = 250,0 mL d’une solution de saccharose C12H22O11 de concentration molaire C = 1,20 x 10 – 2
mol / L.- Déterminer la valeur de la masse ms de saccharose à peser.
- Masse molaire du saccharose : Ms = M ( C12H22O11) = 342 g / mol
- Il faut utiliser la relation (1) liant la masse, la quantité de matière et la masse molaire :
- mS = nS . M (S) (1)
- Il faut utiliser la relation liant (6) la concentration, la quantité de matière et le volume :
- 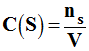 (6)
(6)
- En combinant ces deux relations, on écrit :
- mS = CS . M (S) . V
- Application numérique : attention aux unités : il faut que les unités de volume soient cohérentes.
- mS = CS . M (S) . V
- mS ≈ 1,20 x 10–2 x 250,0 x 10–3 x 342
- mS ≈
- Le résultat : 1,026 : on arrondit et on garde 3 chiffres significatifs (comme la donnée qui en comporte le moins)
c)- Concentration massique. (Rappel de 5ième)
- On parle aussi de teneur massique ou de titre massique.
- La concentration massique d’une espèce moléculaire A d’une solution est définie par la relation suivante :
|
|
(7) |
► m (A) : Masse
de l’espèce moléculaire
A
dissoute en g
► V :
Volume de la solution en L
► t
(A) : Titre
massique ou concentration massique en g / L |
![]() Application 5
:
Application 5
:
- déterminer le titre massique de la concentration en saccharose de l’application précédente.
- Titre massique en saccharose de la solution :
- 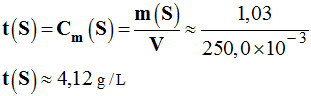
- Pour aller plus loin :
- Déterminer la relation liant la concentration molaire et la concentration massique.
-
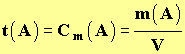 avec
mA
=
nA
.
M
(A)
avec
mA
=
nA
.
M
(A)
- On
tire :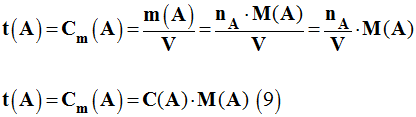
- On peut refaire l’application précédente en utilisant cette relation :
- t
(s)
=
Cm
(S) =
CS
.
M
(S)
- t
(s)
≈
1,20
x
10
– 2
x
342
- t
(s)
≈
III-
Quantité de matière d’un gaz.![]()
a)- Propriétés des gaz
- Les gaz sont expansibles (ils occupent tout le volume offert).
- Ils sont compressibles.
- Tous les gaz ont une structure moléculaire.
- À l’état gazeux règne le chaos moléculaire.
- Les molécules se déplacent dans toutes les directions de façon désordonnée.
- Pour déterminer la quantité de matière d’un échantillon de gaz, il faut connaître sa température, son volume et sa pression.
b)- Pression d’un gaz.
- Par définition, la pression d’un gaz est donnée par la relation suivante :
|
(8) |
► F
: Force pressante en newton N
► S
: Aire de la surface plane en m
2
► p
: Pression en pascal
Pa |
- unité légale de pression.
- Par définition, l’unité légale de pression est le pascal de symbole Pa.
- C’est la pression exercée par une force pressante de 1 N sur une surface plane de 1 m2.
- On emploie couramment d’autres unités :
- Le bar (bar) : 1 bar = 105 Pa
- L’hectopascal : 1 hPa = 102 Pa = 1 mbar
c)- La température absolue.
- L’agitation des molécules constituant un gaz, sous faible pression caractérise son état thermique.
- L’agitation des molécules qui constituent un gaz est liée a une grandeur macroscopique : la température absolue du gaz, notée T.
- L’unité de température absolue est le kelvin : symbole K.
- La température absolue étant liée à l’agitation des molécules d’un gaz, on ne peut pas refroidir indéfiniment un gaz.
- Lorsque la température diminue, l’agitation thermique diminue aussi.
- Lorsque les molécules sont immobiles, il n’y a plus d’agitation thermique et on ne peut plus refroidir : c’est le zéro absolu.
- En l’absence de toute agitation thermique la température T = 0 K.
- C’est le zéro absolu où toutes les particules sont immobiles.
- Au zéro absolu, la température absolue est nulle, la pression est nulle et il n’y a plus d’agitation thermique.
- La température absolue est une grandeur obligatoirement positive.
- Relation :
- L’échelle de température Celsius (température notée θ) se déduit de la température absolue (température notée T) par la relation :
- T
(K) =
θ
°
C +
273,15
- On peut utiliser la relation approchée :
- T
(K)
≈
θ
°
C +
273
2)- Équation d’état du gaz parfait.
- Les quatre paramètres pression p, volume V, température absolue T et quantité de matière n sont liés par une relation appelée :
- Équation d’état du gaz parfait.
|
p . V = n . R . T |
(9) |
► p
: Pression en pascal (Pa)
► V :
Volume en mètre cube ( m3
) ► n : Quantité de matière (mol) |
- R est la constante du gaz parfait : R ≈ 8,31 J . K– 1 . mol – 1
- On appelle gaz parfait, le gaz pour lequel la relation précédente est vérifiée.
- Condition d’utilisation de l’équation d’état.
- Le gaz parfait est un modèle.
- Pour un gaz réel, p.V ≈ n.R.T si la pression est faible et si la température n'est pas trop basse.
- Dans les conditions habituelles de température et de pression, l’air (mélange de gaz) se comporte comme un gaz parfait.
- Cette relation permet de déterminer la quantité de matière d’un échantillon de gaz connaissant sa température son volume et sa pression.
- Application :
- Soit un flacon de volume V = 1,1 L empli de dichlore sous la pression p = 1013 hPa à la température θ = 20,0 ° C.
- Calculer la quantité de matière n de dichlore présente dans le flacon :
- Il faut exprimer la pression p en pacal Pa.
- p = 1,03 x 105 Pa
- Il faut utiliser la température absolue T :
- T (K) ≈ θ ° C + 273
- T ≈ 20 + 273
- T ≈ 293 K
- Quantité de matière de dichlore :
- 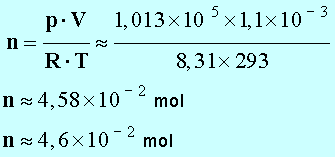
a)- Définition.
- Le volume molaire Vm est le volume d’une mole du gaz parfait .
- Il s’exprime en mol / L.
- Application 6 :
- Calculer le volume molaire du gaz parfait dans les conditions normales de température et de pression.
- C.N.T.P : θ = 0 ,00 °C et p = 1013 hPa.
- Le volume molaire Vm est le volume d’une mole du gaz parfait : n = 1 et d’après l’équation état d’un gaz parfait :
- 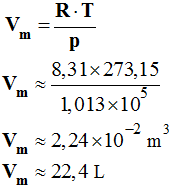
- Remarque :
la formule
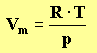 montre que le volume molaire du gaz parfait dépend de la température et de la
pression.
montre que le volume molaire du gaz parfait dépend de la température et de la
pression.
- La plupart des gaz sous des pressions inférieures à quelques bars se comportent comme un gaz parfait.
- Leur volume molaire est égal à celui du gaz parfait.
- C’est la Loi d’Avogadro – Ampère.
![]() Application
7 :
Application
7 :
- Calculer le volume molaire du gaz parfait dans les conditions standard définies par : p = 1,00 bar et θ = 20,0 ° C.
- Volume molaire d’un gaz dans les conditions standard.
- 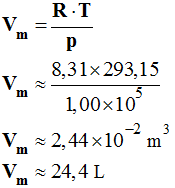
b)- Relation entre le volume molaire et la quantité de matière.
- Les relations :
-
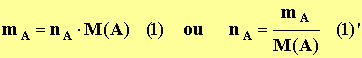 sont valables pour les solides,
les liquides et les gaz.
sont valables pour les solides,
les liquides et les gaz.
- Il est plus facile de mesurer le volume d’un gaz que sa masse.
- Relation :
|
|
(10) |
► n : Quantité
de matière de l'espèce chimique gazeuse en mol
► Vm : Volume molaire de l'espèce chimique considérée
en L
► V
: Volume de l’espèce chimique gazeuse en L |
![]() Application 8
:
Application 8
:
- Au cours d’une expérience, on recueille un volume V = 24 mL de dioxyde de carbone.
- On donne le volume molaire dans les conditions de l’expérience : Vm = 22 L / mol
- Calculer la quantité de matière n de dioxyde de carbone recueilli.
- quantité de matière n de dioxyde de carbone recueilli.
- 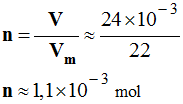
1)- QCM :
|
QCM : Pour s'auto-évaluer La quantité de matière (sous forme de tableau) La quantité de matière (Questy) Pour s'auto-évaluer |
2)- Exercices : énoncé avec correction
|
Jeudi 19 Octobre |
Jeudi 9 Novembre |
|
Livre de Chimie |